- 제약·바이오
- 외자사
릴리, RET 표적 치료제 '레테브모' 국내 승인
-
가
-
식약처 신속심사 통해 최초 허가 획득한 RET 억제제
전이성 RET 융합-양성 비소세포폐암 등 처방 가능
한국릴리는 국내 최초로 RET(REarranged drug Transfection) 표적치료제 레테브모(성분명 셀퍼카티닙)가 식품의약품안전처로부터 허가를 받았다고 14일 밝혔다.

레테브모는 융합 및 점 돌연변이를 포함한 RET 유전자 변이를 표적하는 RET 억제제로 지난 2020년 미국에서 신속심사, 우선심사, 혁신의약품 및 희귀의약품 지정 등을 적용받아 승인된 바 있다.
레테브모는 ▲전이성 RET 융합-양성 비소세포폐암 성인 환자 ▲전신요법을 요하는 진행성 또는 전이성 RET-변이 갑상선 수질암이 있는 성인 및 만 12세 소아 환자 ▲방사선 요오드에 불응하고 이전에 소라페닙 및/또는 렌바티닙 치료 경험이 있으면서 전신요법을 요하는 진행성 또는 전이성 RET 융합-양성 갑상선암 성인 환자 등에 사용 가능하다.
이번 허가는 RET 변이가 있는 진행성 혹은 전이성 고형암 환자 702명을 대상으로 진행된 LIBRETTO-001 연구가 기반이 됐다.
해당 연구에는 이전에 치료 받은 경험이 있거나 없는 RET 융합-양성 비소세포폐암 환자, RET-변이 갑상선 수질암 환자, RET 융합-양성 갑상선암 환자가 참여했다.
주요 목표점은 독립적 검토위원회에서 평가한 객관적반응률(ORR)과 반응지속기간(DOR) 등으로 설정했다.
연구 결과 백금기반 항암화학요법 치료 경험이 없는 RET 융합-양성 비소세포폐암 환자군에서의 ORR은 85%였으며, 7.4개월(중앙값) 동안 79%에서 지속적인 반응을 보여 DOR은 중앙값에 도달하지 않았다.
백금기반 항암화학요법 치료 경험이 있는 환자군에서의 ORR은 64%(95% CI 54-73), DOR 중앙값은 17.5개월(95% CI 12.0-NE)로 나타났다.
또한 비소세포폐암 2차 목표점으로 중추신경계 전이 환자의 ORR도 평가한 결과 백금기반 화학항암요법 치료 경험이 있고 뇌전이 부위 측정 가능한 RET 융합-양성 비소세포폐암 환자 11명 중 10명에서 중추신경계 ORR을 확인했다.
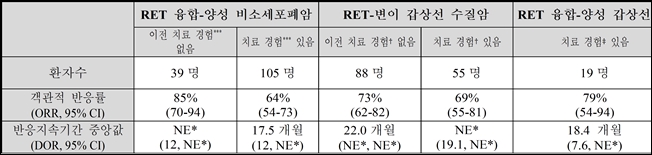
이와 함께 레테브모는 갑상선암 환자군에서도 효과를 확인했다. 이전에 반데타닙 또는 카보잔티닙 치료 경험이 없는 RET-변이 갑상선 수질암 환자군에서 레테브모의 객관적반응률은 73%, 완전 반응(Complete Response, CR) 비율은 11%였다.
반응지속기간 중앙값은 22.0개월이었다. 반데타닙 또는 카보잔티닙 치료 경험이 있는 환자군에서 객관적반응률은 69%였고, 추적 기간 동안 84%의 환자가 지속적인 반응을 보여 반응지속기간은 중앙값에 도달하지 않았다.
마지막으로 이전에 소라페닙 또는 렌바티닙 치료 경험이 있는 RET 융합-양성 갑상선암 환자군에서 레테브모의 객관적반응률은 79%(95% CI, 54-94), 반응지속기간 중앙값은 18.4개월이었다.
RET 융합-양성 갑상선암의 주요 2차 평가변수 중 하나인 무진행생존기간의 중앙값은 20.1개월로 확인됐다.
연세암병원 폐암센터 조병철 교수는 "그동안 RET 유전자 돌연변이 암 환자를 위한 치료 옵션이 없어 일반 암 환자들과 동일하게 항암화학요법을 진행할 수밖에 없었다"며 "전이성 RET 융합-양성 비소세포폐암 치료의 새로운 이정표가 될 것으로 예상된다"고 말했다.
관련기사
- 국내 제약 바이오 성과 주목...AACR서 눈길끈 연구는 2021-04-13 05:45:58
- RET 돌연변이 표적항암제 '레테브모' 갑상선암 먼저 뚫나 2020-08-27 12:00:56
- 더 센 항암제가 온다...다중표적기전 처방시장 속속 진입 2020-05-12 05:45:56
- 미FDA, RET 돌연변이 표적약 '레테브모' 허가 2020-05-11 12:04:22






