- 정책
- 제도・법률
식약청, 의료기기 추적관리 혈관용스텐트 등 추가
9개에서 15개 품목으로 확대…"안전관리 강화 차원"

최선 기자
기사입력: 2012-09-11 11:15:26
-
가
부작용이나 결함으로 인체에 치명적인 위해를 줄 수 있어 추적관리가 필요한 의료기기 대상이 선진국 수준으로 확대된다.
11일 식품의약품안전청(청장 이희성)은 "사용 중 부작용 또는 결함의 발생으로 인체에 치명적인 위해를 줄 수 있어 소재파악이 필요한 추적관리대상 의료기기를 기존 9개에서 15개 품목으로 확대·지정한다"고 밝혔다.
이번 품목 확대는 추적관리 대상을 선진국 수준으로 끌어올리기 위한 것. 현재 미국은 19개 품목, 일본은 8개 품목을 추적관리대상 의료기기로 지정해 관리하고 있다.
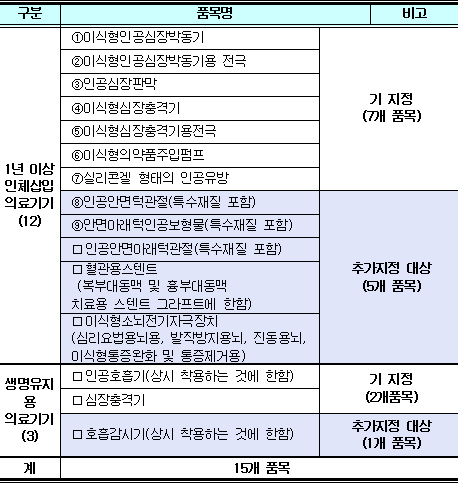
추적관리대상 의료기기 지정 현황
추적관리대상은 인체에 1년 이상 삽입하거나 생명 유지용 의료기기 중 의료기관 외의 장소에서 사용이 가능한 ▲인공안면턱관절 ▲안면아래턱인공보형물 ▲인공안면아래턱관절 ▲혈관용스텐트 ▲이식형소뇌전기자극장치 등이 새롭게 지정됐다.
기존 7개 품목은 ▲이식형인공심장박동기 ▲인공심장판막 ▲이식형심장충격기 ▲이식형의약품주입펌프 ▲실리콘겔 형태의 인공유방 등이다.
식약청은 지난 7월 다빈도 부작용보고 품목인 실리콘겔 인공유방, 심장충격기와 인공호흡기 등 3개 품목을 대상으로 업체 13곳, 판매업체 7곳, 의료기관 10곳을 점검한 바 있다.
수입·판매업체는 물론 의료기관까지 해당 추적관리 의료기기의 소재파악이 가능한 것으로 확인됐지만 심장충격기를 수입한 신생기업은 해당기기에 대한 기록이 미비해 판매업무정지처분이 진행 중이다.
식약청은 "안전관리를 강화하기 위해 추적관리대상 의료기기 지정을 지속적으로 확대해 나갈 계획이다"고 덧붙였다.
11일 식품의약품안전청(청장 이희성)은 "사용 중 부작용 또는 결함의 발생으로 인체에 치명적인 위해를 줄 수 있어 소재파악이 필요한 추적관리대상 의료기기를 기존 9개에서 15개 품목으로 확대·지정한다"고 밝혔다.
이번 품목 확대는 추적관리 대상을 선진국 수준으로 끌어올리기 위한 것. 현재 미국은 19개 품목, 일본은 8개 품목을 추적관리대상 의료기기로 지정해 관리하고 있다.

기존 7개 품목은 ▲이식형인공심장박동기 ▲인공심장판막 ▲이식형심장충격기 ▲이식형의약품주입펌프 ▲실리콘겔 형태의 인공유방 등이다.
식약청은 지난 7월 다빈도 부작용보고 품목인 실리콘겔 인공유방, 심장충격기와 인공호흡기 등 3개 품목을 대상으로 업체 13곳, 판매업체 7곳, 의료기관 10곳을 점검한 바 있다.
수입·판매업체는 물론 의료기관까지 해당 추적관리 의료기기의 소재파악이 가능한 것으로 확인됐지만 심장충격기를 수입한 신생기업은 해당기기에 대한 기록이 미비해 판매업무정지처분이 진행 중이다.
식약청은 "안전관리를 강화하기 위해 추적관리대상 의료기기 지정을 지속적으로 확대해 나갈 계획이다"고 덧붙였다.

관련기사
- "실리콘유방 부작용 은폐…전면 실태조사" 2010-10-10 20:34:54









