- 의료기기·AI
- 진단
대동맥 판막 치환술시스템 '코어밸브' FDA 승인
임상 결과 환자 생존율 높고 합병증 발현률 낮아

정희석 기자
기사입력: 2014-01-21 12:30:47
-
가
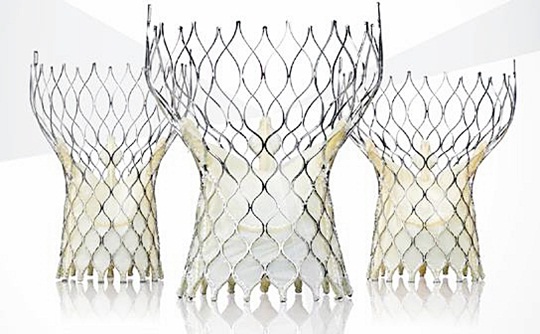
21일 메드트로닉코리아는 FDA가 미국에서의 임상결과 검토 후 독립적 의료기기 자문패널(independent device advisory panel) 검토를 면제하고 코어밸브를 승인했다고 밝혔다.
임상연구 결과 코어밸브는 환자 생존율이 높고 뇌졸중 및 밸브 누출 위험이 낮아 안전성과 효과를 인정받았다.
임상 결과에 따르면, 일차 연구목표인 시술 1년 후 환자 사망 및 심각한 뇌졸중 발현률 면에서 FDA와 공동으로 설정한 목표치보다 40.7%가 낮은 25.5%를 기록했다.
시술 1개월 후 뇌졸중 발현률은 2.4%였으며, 이는 시술 1년 후에도 4.1%에 머물렀다.
또 코어밸브로 시술받은 환자의 75.6%는 시술 1년 후에도 생존했다.
임상연구를 진행한 베스 이스라엘 디커니스 메디컬센터 (Beth Israel Deaconess Medical Center) 제프리 포프마(Jeffrey J. Popma) 박사는 "판막 치환술에 있어 뇌졸중과 밸브 누출은 환자 사망 위험을 높이고 삶의 질에 엄청난 영향을 미친다는 점에서 가장 우려스러운 합병증"이라고 설명했다.
이어 "코어밸브가 두 가지 합병증의 발현률이 낮게 나타났다는 점에서 카테타 기반 판막 치환술에 있어 새로운 기준을 세웠다"고 평했다.
코어밸브는 또한 미국 임상에서 혈행 및 혈류 역학적인 측면에서도 현행 최고의 치료기준인 외과적 판막삽입술에 필적하는 결과를 보였다.
밸브 누출 면에서도 자체 팽창 방식의 판막이 환자 대동맥의 환형에 자리 잡는 과정에서 점차 그 발현률이 낮아지는 경향을 보였다.
더욱이 밸브 누출의 점차적 감소는 여타 주요 TAVR 연구에서는 보고된 바 없는 결과다.
다양한 형태의 대동맥 협착증 환자를 위해 개발된 코어밸브는 FDA로부터 직경 23mm, 26mm, 29mm, 31mm 등 제품라인 전체에 대해 승인을 받았다.
특히 자체 팽창되는 니티놀(nitinol) 재질을 적용해 적절한 조절과 정확한 안착이 가능하고, 동종 최소 수준인 6mm 크기의 전달 시스템을 통해 이식할 수 있어 혈관이 작고 시술이 어려운 환자에게도 적용이 가능하다.

의료기기·AI 기사
- "도시바 브랜드 대학병원에서도 인정" 2014-01-20 09:00:33
- 바텍, 중국 치과CT시장서 '고공행진' 2014-01-15 10:29:00
- 관상동맥질환 차세대 약물방출스텐트 국내 상륙 2014-01-15 10:00:41
- "1년 뒤 허리 2인치 못 줄이면 피자 20판 쏘겠다" 2014-01-13 06:30:00
- 하이로닉, 경쟁사와 특허권 상호인정 합의 2014-01-10 14:34:11









