- 제약·바이오
- 국내사
인슐린 콤보주사제, 릭실란vs아이덱리라 '온도차'
GLP-1/인슐린 콤보약 FDA 승인 두고 엇갈린 반응

원종혁 기자
기사입력: 2016-08-30 05:00:29
-
가
GLP-1 유사체와 기저 인슐린을 섞은 제2형 당뇨병 콤보주사제의 승인을 두고, 사노피와 노보노디스크제약에 온도차가 예상된다.
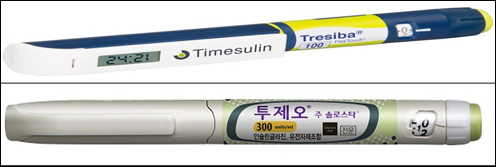
사노피의 '릭실란(LixiLan, 성분명 릭시세나타이드/인슐린 글라진)'과 노보노디스크의 '아이덱리라(IDegLira, 성분명 리라글루타이드/인슐린 디글루덱)'를 두고 나오는 평가다.
승인과정이 순탄한 쪽은 노보노디스크다.
노보노디스크의 경우 GLP-1 유사체 '빅토자(성분명 리라글루타이드)'와 장기 지속형 인슐린 디글루덱인 '트레시바'를 섞은 아이덱리라로 미국 승인을 목전에 두고 있다.
앞서 5월 열린 미국식품의약국(FDA) 자문위원회 논의에서도 전원 찬성(찬성 16표)으로 승인을 권고받았다. 이미 유럽지역에서는 '줄토피(Xultophy)'라는 제품명으로 승인을 마친 상태.
그런데 사노피는 사정이 조금 다르다.
약물전달장치 문제? 적정용량 투약에 "실수 여지"
사노피의 GLP-1 유사체 '릭시세나타이드'와 '란투스(성분명 인슐린 글라진)'의 콤보주사제인 릭실란은, 두 가지 펜용량 사용에 따른 '약물전달장치(Delivery Device)'를 문제로 지적받았다.
이와 관련 FDA는 사노피측에 추가자료를 요청하는 한편, PDUFA(전문의약품 허가 신청자 비용부담법)에 따라 오는 11월까지로 승인을 3개월 미룬 것으로 알려졌다.
지난 5월 25일 열린 FDA 자문위 논의에서도 찬성 12표, 반대 2표로 과반에 의한 승인은 권고됐지만, 회의에 참석한 패널의 일부는 이러한 문제점을 지적한 바 있다.
릭실란의 펜타입은 인슐린 글라진과 릭시세나타이드의 용량을 2대 1의 비율로 섞은 'A형'과 3대 1 비율의 'B형' 두 가지가 승인신청에 들어간 상황이다.
FDA는 "펜타입의 분리로 인한 처방과 조제에서 실수의 여지가 늘어날 수 있다"며 적정용량 투약에 문제가 생길 수 있다는 입장이다.
이에 사노피 글로벌 본사측은 "하루 한 번 고정용량 콤보주사제의 신약승인신청(NDA)과 관련해 FDA가 펜탑의 전달기기에 대한 추가적인 자료를 요청한 것"이라고 성명서를 냈다.
일각에서 '미국시장 선점을 놓고 노보노디스크보다 뒤쳐질 것'이란 관측이 나오는 이유다.
릭실란에 적용된 '솔로스타'
한편, 릭실란에 적용되는 '솔로스타(SoloStar) 펜'은 그동안 인슐린 글라진에도 사용돼 왔다.
란투스에 이어 국내 시장 출시 8개월만에 월 매출 10억원을 달성한 장기 지속형 기저인슐린 투제오(성분명 인슐린 글라진 유전자 재조합 300U/mL)에도 솔로스타가 적용됐다.

사노피의 '릭실란(LixiLan, 성분명 릭시세나타이드/인슐린 글라진)'과 노보노디스크의 '아이덱리라(IDegLira, 성분명 리라글루타이드/인슐린 디글루덱)'를 두고 나오는 평가다.
승인과정이 순탄한 쪽은 노보노디스크다.
노보노디스크의 경우 GLP-1 유사체 '빅토자(성분명 리라글루타이드)'와 장기 지속형 인슐린 디글루덱인 '트레시바'를 섞은 아이덱리라로 미국 승인을 목전에 두고 있다.
앞서 5월 열린 미국식품의약국(FDA) 자문위원회 논의에서도 전원 찬성(찬성 16표)으로 승인을 권고받았다. 이미 유럽지역에서는 '줄토피(Xultophy)'라는 제품명으로 승인을 마친 상태.
그런데 사노피는 사정이 조금 다르다.
약물전달장치 문제? 적정용량 투약에 "실수 여지"
사노피의 GLP-1 유사체 '릭시세나타이드'와 '란투스(성분명 인슐린 글라진)'의 콤보주사제인 릭실란은, 두 가지 펜용량 사용에 따른 '약물전달장치(Delivery Device)'를 문제로 지적받았다.
이와 관련 FDA는 사노피측에 추가자료를 요청하는 한편, PDUFA(전문의약품 허가 신청자 비용부담법)에 따라 오는 11월까지로 승인을 3개월 미룬 것으로 알려졌다.
지난 5월 25일 열린 FDA 자문위 논의에서도 찬성 12표, 반대 2표로 과반에 의한 승인은 권고됐지만, 회의에 참석한 패널의 일부는 이러한 문제점을 지적한 바 있다.
릭실란의 펜타입은 인슐린 글라진과 릭시세나타이드의 용량을 2대 1의 비율로 섞은 'A형'과 3대 1 비율의 'B형' 두 가지가 승인신청에 들어간 상황이다.
FDA는 "펜타입의 분리로 인한 처방과 조제에서 실수의 여지가 늘어날 수 있다"며 적정용량 투약에 문제가 생길 수 있다는 입장이다.
이에 사노피 글로벌 본사측은 "하루 한 번 고정용량 콤보주사제의 신약승인신청(NDA)과 관련해 FDA가 펜탑의 전달기기에 대한 추가적인 자료를 요청한 것"이라고 성명서를 냈다.
일각에서 '미국시장 선점을 놓고 노보노디스크보다 뒤쳐질 것'이란 관측이 나오는 이유다.
릭실란에 적용된 '솔로스타'
한편, 릭실란에 적용되는 '솔로스타(SoloStar) 펜'은 그동안 인슐린 글라진에도 사용돼 왔다.
란투스에 이어 국내 시장 출시 8개월만에 월 매출 10억원을 달성한 장기 지속형 기저인슐린 투제오(성분명 인슐린 글라진 유전자 재조합 300U/mL)에도 솔로스타가 적용됐다.

관련기사
- '투제오' 쫓는 '트레시바', 2분기 점유율 2배↑ 2016-08-25 11:41:56
- 란투스 정조준 '트레시바' 빅4 병원 처방 본격화 2016-01-25 11:09:25









