- 제약·바이오
- 국내사
미 FDA, 신규 부작용 보고 27개 의약품 '예의주시'
유해사례 보고시스템 업데이트…당뇨병약부터 C형간염약까지

원종혁 기자
기사입력: 2016-10-13 05:00:55
-
가
베스트셀링 당뇨병약부터 이제 막 시장에 자리잡기 시작한 차세대 C형간염약까지, 환자 처방에 각별한 주의가 예고됐다.
2016년 2분기 미국식품의약국(FDA) 의약품 유해사례 보고시스템(FAERS)에 접수된 안전성 이슈 감시목록엔 C형간염 치료제인 차세대 경구용 바이러스직접작용제제(DAA)를 필두로, DPP4 억제제와 SGLT2 억제제 당뇨병약, 항우울제, 다발성경화증, 폐동맥고혈압약 등 27개 약물군이 이름을 올렸다.
이렇게 분기별로 공개되는 FAERS 감시목록은 약물과 이상반응의 '인과관계'가 확인된 경우 외에도, 그 연관성을 검증하는데 목적을 두고 있다.
따라서 제출된 임상 데이터를 근거로 안전성 이슈가 확인된 약물은 '의약품 위해관리제도(Risk Evaluation and Mitigation Strategy, 이하 REMS)'에 따라 라벨을 변경하거나, 드물게는 해당 시장에서 퇴출되기도 한다.
C형간염약 다클린자, 소발디, 하보니 등 9종 'B형간염 재활성화 의혹'
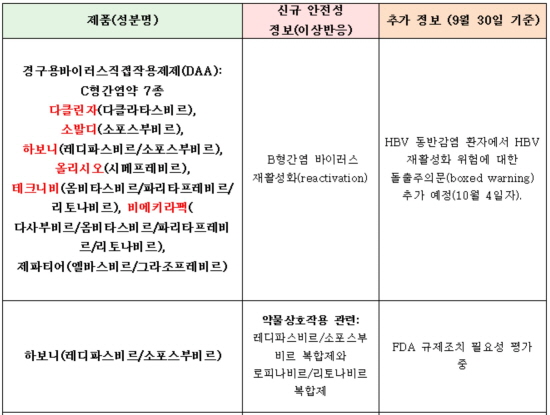
출처: FDA '의약품부작용보고시스템' 업데이트 약물군 자료 재취합.
특히 FDA는 지난 5일 차세대 C형간염약인 경구용 DAA '9개 품목'에 안전성 서한을 배포하고 나섰다. B형간염 감염에 기왕력이 있는 C형간염 환자에서 이들 DAA를 사용한 경우, 치명적인 B형간염 바이러스(HBV)의 재활성화(reactivation)가 발생할 수 있다는 경고문이었다.
여기엔 최근 국내 시장에서 급여를 받으며 안착한 BMS의 다클린자(성분명 다클라타스비르)와 길리어드 사이언스의 소발디(성분명 소포스부비르) 및 하보니(성분명 레디파스비르/소포스부비르)가 포함됐다.
이외 엡클루사(성분명 소포스부비르+벨파타스비르), 올리시오(성분명 시메프레비르), 테크니비(성분명 옴비타스비르+파리타프레비르+리토나비르), 비에키라팩(다사부비르+옴비타스비르+파리타프레비르+리토나비르), 비에키라팩XR, 제파티어(성분명 엘바스비르+그라조프레비르) 등이 거론됐다.
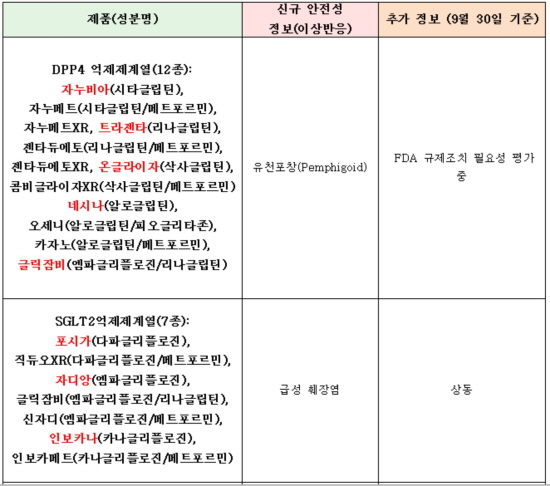
제2형 당뇨병약 시장에 높은 점유율을 보이는 DPP4 억제제계열 '12종'과 최근 진입한 SGLT2 억제제 '7종'도 리스트에 올랐다.
안전성 이슈에서 비교적 선방을 해온 DPP4 억제제계열 당뇨병약은 유사천포창(pemphigoid)이 보고되며, FDA가 규제조치 필요성을 평가 중인 것으로 알려졌다.
또한 SGLT2 억제제는 급성 췌장염 발생 의혹이라는 꼬리표를 떼지 못했다.
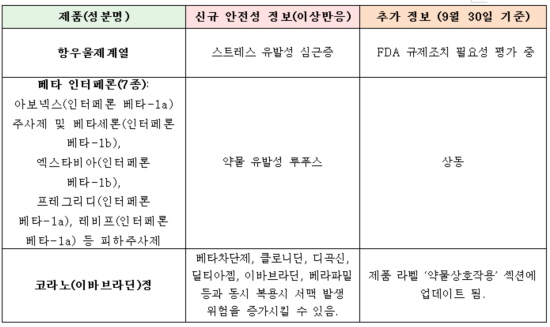
암젠의 경구용 만성 심부전 치료제 '코라노(성분명 이바브라딘)'는 베타차단제 및 클로니딘, 디곡신, 딜티아젬, 베라파밀 등과 동시 투약시 '서맥 발생 위험'을 증가시킬 수 있다는 내용이 제품 라벨에 업데이트됐다.
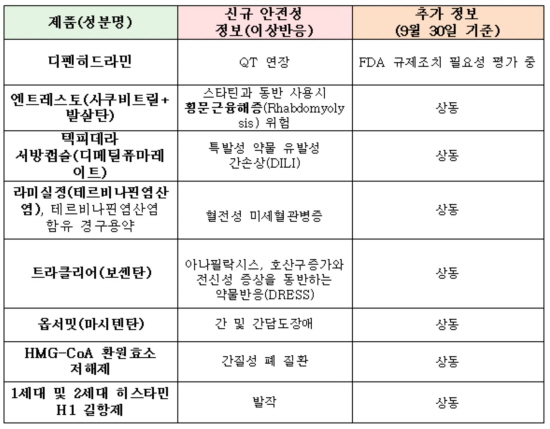
노바티스의 심부전약 '엔트레스토(성분명 사쿠비트릴+발살탄)'도 스타틴과 함께 사용시 횡문근융해증이, UCB제약의 경구용 다발성 경화증 치료제 '텍피데라(성분명 디메틸퓨마레이트)'는 특발성 약물 유발성 간손상(DILI) 발생 위험이 평가 중이다.
노바티스의 피부진균증약 라미실(성분명 테르비나핀염산염)정과 테르비나핀염산염 함유 경구약은 혈전성 미세혈관병증이 제기됐다.
폐동맥고혈압약 트라클리어(성분명 보센탄)와 후속제제인 옵서밋(성분명 마시텐탄)도 예외는 아니었다.
트라클리어는 아나필락시스 와 호산구증가와 전신성 증상을 동반하는 약물반응(DRESS)이, 옵서밋은 간 및 간담도장애가 관찰됐다.
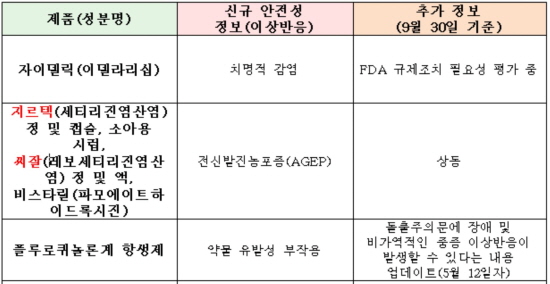
이 밖에도 지르텍(성분명 세티리진염산염)과 씨잘(성분명 레보세티리진염산염) 등 알레르기 비염약으로 유명한 항히스타민제는 전신발진농포증(AGEP)이 도마에 올랐다.
또 만성 림프구성백혈병(CLL) 등의 3개 암종에 사용되는 길리어드의 자이델릭(성분명 이델라리십)을 복용한 환자에서는 치명적인 감염증이 보고되기도 했다.
지난 7월 유럽의약국(EMA) 역시 이러한 문제를 지적한 바 있다. 다만 EMA의 경우엔 자이델릭의 위험보다는 혜택에 무게를 두고, 복용 환자에 예방적 항생제의 사용을 권고했다.
한편 이번 감시목록엔 2개 약물이 따로 언급됐다. 비슷한 이름으로 의료진의 처방에 혼동이나 실수가 발생할 수 있기 때문.
고혈압과 울혈성 심부전에 사용되는 '하이드랄라진(Hydralazine)'과 알레르기성 가려움증과 불안증에 쓰이는 하이드록시진'(Hydroxyzine)이 그 주인공이었다.
2016년 2분기 미국식품의약국(FDA) 의약품 유해사례 보고시스템(FAERS)에 접수된 안전성 이슈 감시목록엔 C형간염 치료제인 차세대 경구용 바이러스직접작용제제(DAA)를 필두로, DPP4 억제제와 SGLT2 억제제 당뇨병약, 항우울제, 다발성경화증, 폐동맥고혈압약 등 27개 약물군이 이름을 올렸다.
이렇게 분기별로 공개되는 FAERS 감시목록은 약물과 이상반응의 '인과관계'가 확인된 경우 외에도, 그 연관성을 검증하는데 목적을 두고 있다.
따라서 제출된 임상 데이터를 근거로 안전성 이슈가 확인된 약물은 '의약품 위해관리제도(Risk Evaluation and Mitigation Strategy, 이하 REMS)'에 따라 라벨을 변경하거나, 드물게는 해당 시장에서 퇴출되기도 한다.
C형간염약 다클린자, 소발디, 하보니 등 9종 'B형간염 재활성화 의혹'
여기엔 최근 국내 시장에서 급여를 받으며 안착한 BMS의 다클린자(성분명 다클라타스비르)와 길리어드 사이언스의 소발디(성분명 소포스부비르) 및 하보니(성분명 레디파스비르/소포스부비르)가 포함됐다.
이외 엡클루사(성분명 소포스부비르+벨파타스비르), 올리시오(성분명 시메프레비르), 테크니비(성분명 옴비타스비르+파리타프레비르+리토나비르), 비에키라팩(다사부비르+옴비타스비르+파리타프레비르+리토나비르), 비에키라팩XR, 제파티어(성분명 엘바스비르+그라조프레비르) 등이 거론됐다.
안전성 이슈에서 비교적 선방을 해온 DPP4 억제제계열 당뇨병약은 유사천포창(pemphigoid)이 보고되며, FDA가 규제조치 필요성을 평가 중인 것으로 알려졌다.
또한 SGLT2 억제제는 급성 췌장염 발생 의혹이라는 꼬리표를 떼지 못했다.
노바티스의 피부진균증약 라미실(성분명 테르비나핀염산염)정과 테르비나핀염산염 함유 경구약은 혈전성 미세혈관병증이 제기됐다.
폐동맥고혈압약 트라클리어(성분명 보센탄)와 후속제제인 옵서밋(성분명 마시텐탄)도 예외는 아니었다.
트라클리어는 아나필락시스 와 호산구증가와 전신성 증상을 동반하는 약물반응(DRESS)이, 옵서밋은 간 및 간담도장애가 관찰됐다.
또 만성 림프구성백혈병(CLL) 등의 3개 암종에 사용되는 길리어드의 자이델릭(성분명 이델라리십)을 복용한 환자에서는 치명적인 감염증이 보고되기도 했다.
지난 7월 유럽의약국(EMA) 역시 이러한 문제를 지적한 바 있다. 다만 EMA의 경우엔 자이델릭의 위험보다는 혜택에 무게를 두고, 복용 환자에 예방적 항생제의 사용을 권고했다.
한편 이번 감시목록엔 2개 약물이 따로 언급됐다. 비슷한 이름으로 의료진의 처방에 혼동이나 실수가 발생할 수 있기 때문.
고혈압과 울혈성 심부전에 사용되는 '하이드랄라진(Hydralazine)'과 알레르기성 가려움증과 불안증에 쓰이는 하이드록시진'(Hydroxyzine)이 그 주인공이었다.

관련기사
- 국정감사 도마 오른 돔페리돈…처방 중단될까 2016-10-08 05:00:58
- 돔페리돈 논란, 의사들은? "정치쇼"VS"처방 신중해야" 2016-10-12 05:00:56









