- 제약·바이오
- 국내사
"신약 허가 3개 중 1개 꼴"…시판후 안전성 발목
2001년~2010년 신약허가 10년간 시판후조사 안전성 분석 결과

원종혁 기자
기사입력: 2017-05-11 12:00:57
-
가
|신약 허가 이상반응 리포트|
"엄격한 신약 허가 심사가, 시판후 부작용 문제까지 예방하는 것은 아니다."
최근 조사 결과, 시판허가를 마친 신약의 30% 수준은 시판후 조사(PMS)에서 승인 당시 알려지지 않은 안전성 이슈로 골머리를 앓았다.
일반적인 화학합성의약품보다 최근 각광받는 생물학적제제에서 안전성 이슈가 더욱 많이 발생했으며, 정신과용제에서 그 위험이 더 높았다.
다만, 신속허가를 받은 신약에서 이상반응 위험이 높았는데 반대로 심사기간이 짧은 신약일 수록 안전성 이슈는 적었다.
미국 하버드의대 니콜라스 다우닝(Nicholas S. Downing) 교수팀(보스톤 브리검여성병원)이 진행한 '신약들의 10년간 시판후 조사 분석 결과'는, 국제 학술지인 JAMA 5월 9일자 온란인판에 게재됐다.
교수팀은 "신약 허가심사를 강화하고 감시체계를 엄격하게 운영하는 것만으로는 모든 신약의 시판후 안전성 문제를 예방할 수 있는 것은 아니다"라고 밝혔다.
이어 다우닝 교수는 "의학적으로 근거수준이 높은 무작위대조군연구(RCT)에서 입증된 신약의 유효성이라고 해도, 실제 리얼월드 데이터의 효과에는 주요한 차이가 있다"면서 "현재 의료계에서는 이에 대한 논의를 진행하고 있다"고 설명했다.
"신약 32%, 시판후 안전성 이상반응에 발목"
허가 신약들의 시판후 안전성 문제를 저울질 해본 다우닝 교수팀의 연구는 2001년 1월부터 2010년 12월까지 FDA에 승인을 받은 신약을 대상으로 했다.
총 222개 신약이 조사대상이 된 가운데 183개가 화학합성약물, 39개가 생물학적제제였다.
이들을 ▲화학합성약물vs생물학적제제 ▲치료 분야 ▲신약허가 우선심사권(Priority Review) ▲가속승인(accelerated approval) ▲희귀의약품 ▲통상적 허가절차를 밟은 품목 ▲총 심사기간 등 7개 기준으로 분류해 시판후 안전성 이슈를 분석했다.
그 결과는 어땠을까.
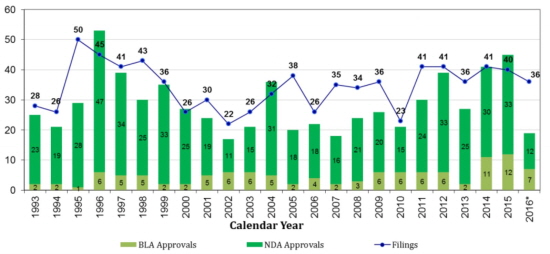
미국FDA 신약허가 품목 수 표 첨부.
11.7년(중앙값)의 추적관찰 기간동안, 71개 신약(32%)에서 123건의 시판후 안전성 이상반응이 보고됐다.
연구팀은 "허가 이후 첫 시판후 조사가 나오기까지는 보통 4.2년 정도의 시간이 걸렸는데, 3개 중 1개 꼴로 10년 동안 1건 이상의 안전성 이벤트가 발생했다"고 밝혔다.
더욱이 동기간 3개 신약은 부작용으로 인해 시장에서 퇴출 절차를 밟았는데, 과민성대장증후군(IBS) 약으로 허가받은 발데콕시브(valdecoxib)와 테가세로드(tegaserod)는 시판후 보고에서 심혈관 위험이 감지되면서 각각 2005년과 2007년 시장 퇴출이 결정됐다.
또 건선약인 에팔리주맙(efalizumab)은 진행성 다초점 백색질 뇌증(Progressive Multifocal Leukoencephalopathy, 이하 PML)이 보고돼 2009년 퇴출됐다.
이외에도 승인된 신약에선 '돌출주의경고문(블랙박스 워닝)'과 '안전성 서한'이 내려진 품목이 다수였다는 대목이다.
약물 계열에 관계없이 총 43개 신약에 61건의 돌출주의경고문이 붙었고, 44개 신약엔 59건의 안전성 서한이 돌았다.
연구팀은 "안전성 이상반응의 발생으로 시장 퇴출 절차를 밟는 신약은 극히 드물지만, 이러한 주의경고문의 삽입된 품목의 경우엔 향후 치명적인 부작용의 발생 가능성이 있어 시판후조사 기간동안 예의주시가 필요하다"고 강조했다.
FDA 관계자는 "안전성 서한은 치명적인 이상반응에 대해 최종 결론을 내는 것은 아니지만, 시판후 조사를 통해 지속적인 관찰이 요구된다는 것"이라며 "돌출주의문이나 안전성 서한은 허가 신약의 약 5분의 1에서 보고된다"고 전했다.
생물학적제제, 정신과용제 이상반응↑…'가속승인 품목↑' '리뷰기간 짧을수록↓'
"지체되는 프리마켓 리뷰, 시판후 안전성 담보 못한다?"
이번 조사 결과를 세부적으로 들여다보면 안전성 이슈는 신약의 특성이나 용도, 승인절차에 따라서도 영향을 받았다.
화학합성의약품 대비 생물학적제제에서 안전성 위험이 93%가 증가했으며, 항암제나 혈액종양 치료제에 비해 정신과용제에서 안전성 이슈가 3.78배 늘었다.
눈에 띄는 대목은 시판후 안전성 조사를 토대로 했을때, 가속승인을 받은 약물에서 안전성 위험은 2.20배 증가했다는 것이다.
이는 정규 허가일에 근접해 승인을 받은 품목에서 안전성 위험이 1.90배 높아진 것과는 비교되는 수치였다.
다만, 아이러니하게도 승인심사 기간이 짧은 약물에서 안전성 문제가 적게 나타났다.
연구팀은 "이러한 결과는 시판 허가전 안전성 조사결과가 시판후 조사에 대한 절대적인 근거가 되지 못한다는 유럽의약품청의 조사와도 결부된다"면서 "결국 추가적으로 이어지는 시판전 리뷰 자료는 신약의 허가를 지연시킬 뿐, 향후 발생할 안전성 문제에 근거를 강화하는 것은 아닐 수 있다"고 덧붙였다.
이와 관련 업계 관계자는 "이미 많은 제약사들이 시판후 이상반응 관리를 강화하기 위해 대규모 임상을 다양하게 진행하면서 신약개발 비용을 늘리고 있다"면서 "신약의 고비용 논란이 계속되는 가운데, 앞으로는 승인 이후 안전성을 효과적으로 평가할 수 있는 체계적인 시스템을 개발할 필요가 있다"고 의견을 냈다.
시판후 안전성 조사를 보다 효율적으로 진행할 수 있는 제도적인 정비가 필요하다는 얘기다.
현재 미국의 경우 추후 신약의 이상반응 관리를 위해 시판후 안전성 감시체계 프로그램을 강화하고 있다.
미국FDA는 새로운 약물감시체계인 'FDA 센티넬(Sentinel Initiative)'을 도입 운용하면서, 의료진들이 전자기록을 통해 허가전 임상데이터를 공유하고 시판후 위험을 포착해 이를 분석할 수 있도록 돕는 것이다.
한 의료계 관계자는 "의과대학에는 신약 이상반응을 감시하고 보고하는 관련 교육과정이 따로 없는 상황인데, 결과적으로 이상반응 보고 이슈는 처방권자인 의료진과 조제자인 약사에 역할이 중요해지는 것"이라면서 "신약을 진료현장에서 사용할 때 우려되는 잠재적인 이상반응을 예의주시해야만 한다"고 밝혔다.
"엄격한 신약 허가 심사가, 시판후 부작용 문제까지 예방하는 것은 아니다."
최근 조사 결과, 시판허가를 마친 신약의 30% 수준은 시판후 조사(PMS)에서 승인 당시 알려지지 않은 안전성 이슈로 골머리를 앓았다.
일반적인 화학합성의약품보다 최근 각광받는 생물학적제제에서 안전성 이슈가 더욱 많이 발생했으며, 정신과용제에서 그 위험이 더 높았다.
다만, 신속허가를 받은 신약에서 이상반응 위험이 높았는데 반대로 심사기간이 짧은 신약일 수록 안전성 이슈는 적었다.

교수팀은 "신약 허가심사를 강화하고 감시체계를 엄격하게 운영하는 것만으로는 모든 신약의 시판후 안전성 문제를 예방할 수 있는 것은 아니다"라고 밝혔다.
이어 다우닝 교수는 "의학적으로 근거수준이 높은 무작위대조군연구(RCT)에서 입증된 신약의 유효성이라고 해도, 실제 리얼월드 데이터의 효과에는 주요한 차이가 있다"면서 "현재 의료계에서는 이에 대한 논의를 진행하고 있다"고 설명했다.
"신약 32%, 시판후 안전성 이상반응에 발목"
허가 신약들의 시판후 안전성 문제를 저울질 해본 다우닝 교수팀의 연구는 2001년 1월부터 2010년 12월까지 FDA에 승인을 받은 신약을 대상으로 했다.
총 222개 신약이 조사대상이 된 가운데 183개가 화학합성약물, 39개가 생물학적제제였다.
이들을 ▲화학합성약물vs생물학적제제 ▲치료 분야 ▲신약허가 우선심사권(Priority Review) ▲가속승인(accelerated approval) ▲희귀의약품 ▲통상적 허가절차를 밟은 품목 ▲총 심사기간 등 7개 기준으로 분류해 시판후 안전성 이슈를 분석했다.
그 결과는 어땠을까.

연구팀은 "허가 이후 첫 시판후 조사가 나오기까지는 보통 4.2년 정도의 시간이 걸렸는데, 3개 중 1개 꼴로 10년 동안 1건 이상의 안전성 이벤트가 발생했다"고 밝혔다.
더욱이 동기간 3개 신약은 부작용으로 인해 시장에서 퇴출 절차를 밟았는데, 과민성대장증후군(IBS) 약으로 허가받은 발데콕시브(valdecoxib)와 테가세로드(tegaserod)는 시판후 보고에서 심혈관 위험이 감지되면서 각각 2005년과 2007년 시장 퇴출이 결정됐다.
또 건선약인 에팔리주맙(efalizumab)은 진행성 다초점 백색질 뇌증(Progressive Multifocal Leukoencephalopathy, 이하 PML)이 보고돼 2009년 퇴출됐다.
이외에도 승인된 신약에선 '돌출주의경고문(블랙박스 워닝)'과 '안전성 서한'이 내려진 품목이 다수였다는 대목이다.
약물 계열에 관계없이 총 43개 신약에 61건의 돌출주의경고문이 붙었고, 44개 신약엔 59건의 안전성 서한이 돌았다.
연구팀은 "안전성 이상반응의 발생으로 시장 퇴출 절차를 밟는 신약은 극히 드물지만, 이러한 주의경고문의 삽입된 품목의 경우엔 향후 치명적인 부작용의 발생 가능성이 있어 시판후조사 기간동안 예의주시가 필요하다"고 강조했다.
FDA 관계자는 "안전성 서한은 치명적인 이상반응에 대해 최종 결론을 내는 것은 아니지만, 시판후 조사를 통해 지속적인 관찰이 요구된다는 것"이라며 "돌출주의문이나 안전성 서한은 허가 신약의 약 5분의 1에서 보고된다"고 전했다.
생물학적제제, 정신과용제 이상반응↑…'가속승인 품목↑' '리뷰기간 짧을수록↓'
"지체되는 프리마켓 리뷰, 시판후 안전성 담보 못한다?"
이번 조사 결과를 세부적으로 들여다보면 안전성 이슈는 신약의 특성이나 용도, 승인절차에 따라서도 영향을 받았다.
화학합성의약품 대비 생물학적제제에서 안전성 위험이 93%가 증가했으며, 항암제나 혈액종양 치료제에 비해 정신과용제에서 안전성 이슈가 3.78배 늘었다.
눈에 띄는 대목은 시판후 안전성 조사를 토대로 했을때, 가속승인을 받은 약물에서 안전성 위험은 2.20배 증가했다는 것이다.
이는 정규 허가일에 근접해 승인을 받은 품목에서 안전성 위험이 1.90배 높아진 것과는 비교되는 수치였다.
다만, 아이러니하게도 승인심사 기간이 짧은 약물에서 안전성 문제가 적게 나타났다.
연구팀은 "이러한 결과는 시판 허가전 안전성 조사결과가 시판후 조사에 대한 절대적인 근거가 되지 못한다는 유럽의약품청의 조사와도 결부된다"면서 "결국 추가적으로 이어지는 시판전 리뷰 자료는 신약의 허가를 지연시킬 뿐, 향후 발생할 안전성 문제에 근거를 강화하는 것은 아닐 수 있다"고 덧붙였다.
이와 관련 업계 관계자는 "이미 많은 제약사들이 시판후 이상반응 관리를 강화하기 위해 대규모 임상을 다양하게 진행하면서 신약개발 비용을 늘리고 있다"면서 "신약의 고비용 논란이 계속되는 가운데, 앞으로는 승인 이후 안전성을 효과적으로 평가할 수 있는 체계적인 시스템을 개발할 필요가 있다"고 의견을 냈다.
시판후 안전성 조사를 보다 효율적으로 진행할 수 있는 제도적인 정비가 필요하다는 얘기다.
현재 미국의 경우 추후 신약의 이상반응 관리를 위해 시판후 안전성 감시체계 프로그램을 강화하고 있다.
미국FDA는 새로운 약물감시체계인 'FDA 센티넬(Sentinel Initiative)'을 도입 운용하면서, 의료진들이 전자기록을 통해 허가전 임상데이터를 공유하고 시판후 위험을 포착해 이를 분석할 수 있도록 돕는 것이다.
한 의료계 관계자는 "의과대학에는 신약 이상반응을 감시하고 보고하는 관련 교육과정이 따로 없는 상황인데, 결과적으로 이상반응 보고 이슈는 처방권자인 의료진과 조제자인 약사에 역할이 중요해지는 것"이라면서 "신약을 진료현장에서 사용할 때 우려되는 잠재적인 이상반응을 예의주시해야만 한다"고 밝혔다.

관련기사
- "희귀약 정부 지원 부족…연구비·세제혜택 넓혀야" 2017-05-08 12:00:15
- "제약은 미래 성장동력…대통령이 직접 나서달라" 2017-05-10 11:51:28









