- 제약·바이오
- 국내사
3상 접어든 코로나19 백신…국가출하승인 수수료 신설
|식약처, 의약품 등 해외제조소 등록 수수료 마련
|의약품 등의 허가 등에 관한 수수료 규정 개정고시

최선 기자
기사입력: 2021-10-21 11:16:38
-
가
임상 3상에 접어든 국내 코로나19 백신과 관련 국가출하승인 수수료 등이 신설된다.
21일 식품의약품안전처는 해외제조소 등록, 코로나19 백신 국가출하승인 등 관련 수수료를 신설하는 내용을 담은 의약품 등의 허가 등에 관한 수수료 규정(식약처 고시)을 개정고시하고 24일부터 적용한다.
이번에 신설한 주요 수수료 종목(전자민원 기준)은 ▲의약품 등 해외제조소 등록 신청 민원 수수료(14만 1,000원) ▲신약 품목허가 신청 후 회의 실시 수수료(80만 3,000원) ▲코로나19 백신 국가출하승인 수수료다.
이번에 신설된 수수료는 의약품 허가 분야에 새롭게 도입된 제도의 적정한 운영을 위해 마련됐다.
식약처는 이번 허가 등 수수료 신설이 의약품 등 해외제조소 등록제도, 코로나19 백신 국가출하승인 업무의 안정적 운영과 안전·품질이 확보된 의약품을 허가하는 데 도움이 될 것으로 기대하고 있다.
전자민원과 방문·우편민원 방식에 따라 금액은 차등 적용된다.
전자민원 방식의 신약 수수료 803만 1천원을 기준으로 이에 대한 대면/화상회의 신청은 10%를 가산한 883만 4천원, 방문·우편민원 수수료 887만 6천원을 기준으로 이에 대한 대면/화상회의 신청은 10%를 가산한 976만 3천원이다.
의약품 등의 해외제조소 등록은 전자민원이 14만 1천원, 방문·우편민원이 14만 8천원, 변경등록은 각각 11만 7천원, 12만 6천원이다.
생물학적제제는 바이러스벡터/mRNA 방식 및 전자/방문·우편민원 방식에 따라 수수료가 다르게 책정됐다.
코로나19 바이러스 벡터 백신의 전자민원 수수료는 241만 2천원, 방문·우편민원은 268만 1천원이다. mRNA 방식의 전자민원 수수료는 290만원, 방문·우편민원은 322만 3천원이다.
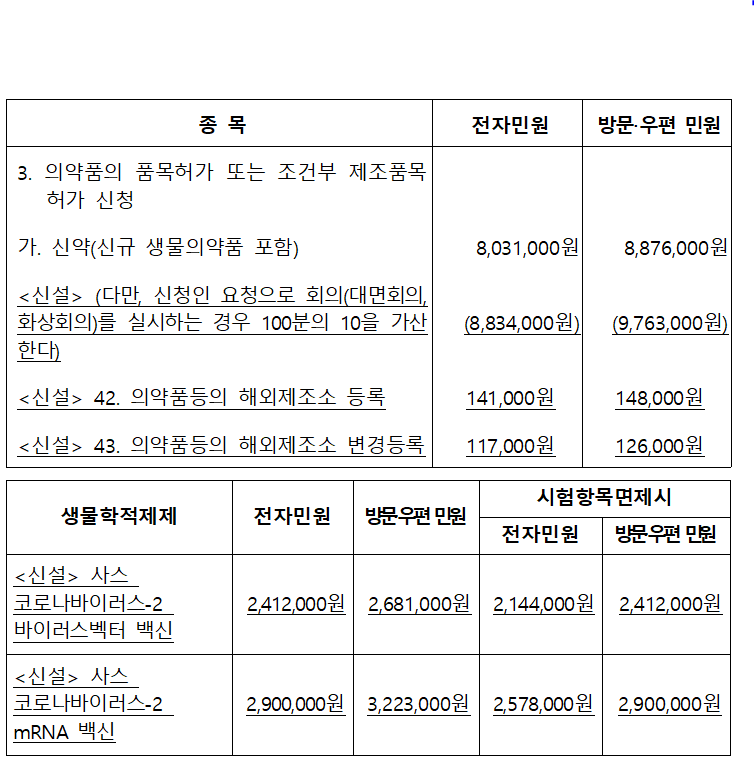
의약품 인허가 분야 및 국가출하승인 의약품의 출하승인 수수료
21일 식품의약품안전처는 해외제조소 등록, 코로나19 백신 국가출하승인 등 관련 수수료를 신설하는 내용을 담은 의약품 등의 허가 등에 관한 수수료 규정(식약처 고시)을 개정고시하고 24일부터 적용한다.
이번에 신설한 주요 수수료 종목(전자민원 기준)은 ▲의약품 등 해외제조소 등록 신청 민원 수수료(14만 1,000원) ▲신약 품목허가 신청 후 회의 실시 수수료(80만 3,000원) ▲코로나19 백신 국가출하승인 수수료다.
이번에 신설된 수수료는 의약품 허가 분야에 새롭게 도입된 제도의 적정한 운영을 위해 마련됐다.
식약처는 이번 허가 등 수수료 신설이 의약품 등 해외제조소 등록제도, 코로나19 백신 국가출하승인 업무의 안정적 운영과 안전·품질이 확보된 의약품을 허가하는 데 도움이 될 것으로 기대하고 있다.
전자민원과 방문·우편민원 방식에 따라 금액은 차등 적용된다.
전자민원 방식의 신약 수수료 803만 1천원을 기준으로 이에 대한 대면/화상회의 신청은 10%를 가산한 883만 4천원, 방문·우편민원 수수료 887만 6천원을 기준으로 이에 대한 대면/화상회의 신청은 10%를 가산한 976만 3천원이다.
의약품 등의 해외제조소 등록은 전자민원이 14만 1천원, 방문·우편민원이 14만 8천원, 변경등록은 각각 11만 7천원, 12만 6천원이다.
생물학적제제는 바이러스벡터/mRNA 방식 및 전자/방문·우편민원 방식에 따라 수수료가 다르게 책정됐다.
코로나19 바이러스 벡터 백신의 전자민원 수수료는 241만 2천원, 방문·우편민원은 268만 1천원이다. mRNA 방식의 전자민원 수수료는 290만원, 방문·우편민원은 322만 3천원이다.


관련기사
- 의약품 부실 허가 원인은? 해외 규제기관과 '체급차' 2020-10-22 05:45:55
- 첨바법 후폭풍 의료기관서 세포 등 조직 채취시 별도 허가 필요 2020-05-29 05:45:56
- 식약처, 라니티딘 계기로 허가 수수료 인상 카드 만지작 2019-10-15 05:45:54
- 전문성 결여 지적에 칼뽑은 식약처...심사 인력 대거 채용 2019-10-11 05:45:57









