- 제약·바이오
- 국내사
삼성-셀트리온, 바이오시밀러 글로벌 침투 선의 경쟁
이석준
발행날짜: 2016-01-20 05:05:29
-
가
-
시기는 셀트리온, 품목수는 삼성…서로 앞길 터주는 역할될 것
삼성바이오에피스와 셀트리온이 선의의 경쟁을 벌이고 있다. 국산 바이오시밀러의 글로벌 시장 침투를 위해서다.
양사는 17일과 18일 하루 걸러 유럽 허가 확정과 미국 승인 임박 소식을 알려왔다. 모두 토종 바이오시밀러 향후 앞길을 터줄 희소식이다.
국산 바이오시밀러 형님 셀트리온 본고장 미국 도전
셀트리온은 토종 바이오시밀러 개척자로 표현된다.
남들보다 앞서 개발에 나섰고 18일에는 미국 최초 항체 바오이시밀러 승인 임박 소식을 전했다.
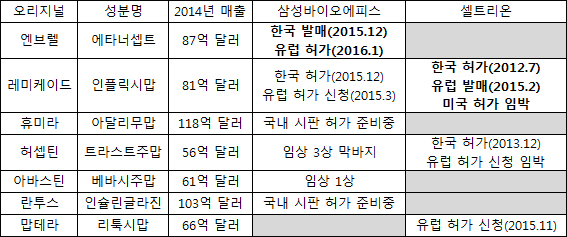
미국 허가 첫 주인공은 이미 국내와 유럽 발매가 이뤄진 '램시마(오리지널 레미케이드, 성분 인플릭시맙)'가 될 공산이 크다.
업계에 따르면, 미국 식품의약품국(FDA)은 오는 2월 9일 관절염 관련 자문위원회를 열어 '램시마' 허가 여부를 논한다. FDA는 자문위원회 도출 의견을 참고해 '램시마' 판매 승인에 대해 최종 결정한다.
지난 2014년 8월 '램시마' FDA 허가 신청 1년 6개월만에 미국 시장 진입이 가시권에 들어온 것이다.
이찬휘 하나금융투자 연구원은 "오는 4월경 FDA 허가가 이뤄진다면 램시마는 미국이 승인한 첫 항체 바이오시밀러로 상당기간 독점적 수혜가 예상된다"고 말했다.
미국 허가 의미는 상당하다.
'램시마'만 봐도 오리지널 글로벌 매출 약 10조원 중 절반 가량이 미국에서 나온다. 특히 까다롭기로 유명한 미국 시판 허가는 타 국가의 승인 작업시 소위 '하이패스'가 될 수 있다.
셀트리온은 '램시마' 말고도 유럽 허가를 노리는 '허셉틴(트라스트주맙)'과 '맙테라(리툭시맙)' 바이오시밀러를 보유 중이다.
여기에 셀트리온 입장에서는 늘상 재기됐던 재고 부담 문제와 실적 논란도 미국 허가로 단숨에 날려버릴 수 있다.
엔브렐 바이오시밀러 첫 유럽 허가…후속 제품 탄력
삼성바이오에피스는 17일 유럽에서 '엔브렐(에타너셉트, SB4)' 바이오시밀러 최초 승인을 받았다.
'엔브렐' 개척자 효과는 향후 삼성이 내놓을 바이오시밀러 시판 허가 과정에서 긍정적인 영향을 줄 것으로 보인다.
현재 삼성은 '레미케이드(인플릭시맙, SB2)', '휴미라(아달리무맙, SB5)', '허셉틴(트라스트주맙, SB3)', '아바스틴(베바시주맙, SB8)', '란투스(인슐린글라진, SB9)' 등의 바이오시밀러를 개발하거나 완료한 상태다.
이중 '엔브렐'과 '레미케이드(국내 상품명 렌플렉시스)' 바이오시밀러는 국내 허가를 받은 상태다. 나머지는 임상시험 중이며 '레미케이드'는 유럽 허가를 신청했다. 삼성은 '휴미라'도 개발에 성공했다고 밝히고 있다.
업계 관계자는 "시기면에서는 셀트리온, 품목수에서는 삼성바이오에피스가 앞서 있는 형국이다. 다만 국산 제품의 글로벌 진출이라는 점에서 선의의 경쟁으로 여겨진다. 서로 앞길을 터주는 셈"이라고 진단했다.
이어 "다른 관전 포인트는 양사의 제휴 업체다. 셀트리온은 화이자(램시마외 판권 반납)를, 삼성은 바이오젠을 영업 파트너로 뒀다. 어떤 영향을 줄지도 지켜볼 부분"이라고 판단했다.
양사는 17일과 18일 하루 걸러 유럽 허가 확정과 미국 승인 임박 소식을 알려왔다. 모두 토종 바이오시밀러 향후 앞길을 터줄 희소식이다.
국산 바이오시밀러 형님 셀트리온 본고장 미국 도전
셀트리온은 토종 바이오시밀러 개척자로 표현된다.
남들보다 앞서 개발에 나섰고 18일에는 미국 최초 항체 바오이시밀러 승인 임박 소식을 전했다.

업계에 따르면, 미국 식품의약품국(FDA)은 오는 2월 9일 관절염 관련 자문위원회를 열어 '램시마' 허가 여부를 논한다. FDA는 자문위원회 도출 의견을 참고해 '램시마' 판매 승인에 대해 최종 결정한다.
지난 2014년 8월 '램시마' FDA 허가 신청 1년 6개월만에 미국 시장 진입이 가시권에 들어온 것이다.
이찬휘 하나금융투자 연구원은 "오는 4월경 FDA 허가가 이뤄진다면 램시마는 미국이 승인한 첫 항체 바이오시밀러로 상당기간 독점적 수혜가 예상된다"고 말했다.
미국 허가 의미는 상당하다.
'램시마'만 봐도 오리지널 글로벌 매출 약 10조원 중 절반 가량이 미국에서 나온다. 특히 까다롭기로 유명한 미국 시판 허가는 타 국가의 승인 작업시 소위 '하이패스'가 될 수 있다.
셀트리온은 '램시마' 말고도 유럽 허가를 노리는 '허셉틴(트라스트주맙)'과 '맙테라(리툭시맙)' 바이오시밀러를 보유 중이다.
여기에 셀트리온 입장에서는 늘상 재기됐던 재고 부담 문제와 실적 논란도 미국 허가로 단숨에 날려버릴 수 있다.
엔브렐 바이오시밀러 첫 유럽 허가…후속 제품 탄력
삼성바이오에피스는 17일 유럽에서 '엔브렐(에타너셉트, SB4)' 바이오시밀러 최초 승인을 받았다.
'엔브렐' 개척자 효과는 향후 삼성이 내놓을 바이오시밀러 시판 허가 과정에서 긍정적인 영향을 줄 것으로 보인다.
현재 삼성은 '레미케이드(인플릭시맙, SB2)', '휴미라(아달리무맙, SB5)', '허셉틴(트라스트주맙, SB3)', '아바스틴(베바시주맙, SB8)', '란투스(인슐린글라진, SB9)' 등의 바이오시밀러를 개발하거나 완료한 상태다.
이중 '엔브렐'과 '레미케이드(국내 상품명 렌플렉시스)' 바이오시밀러는 국내 허가를 받은 상태다. 나머지는 임상시험 중이며 '레미케이드'는 유럽 허가를 신청했다. 삼성은 '휴미라'도 개발에 성공했다고 밝히고 있다.
업계 관계자는 "시기면에서는 셀트리온, 품목수에서는 삼성바이오에피스가 앞서 있는 형국이다. 다만 국산 제품의 글로벌 진출이라는 점에서 선의의 경쟁으로 여겨진다. 서로 앞길을 터주는 셈"이라고 진단했다.
이어 "다른 관전 포인트는 양사의 제휴 업체다. 셀트리온은 화이자(램시마외 판권 반납)를, 삼성은 바이오젠을 영업 파트너로 뒀다. 어떤 영향을 줄지도 지켜볼 부분"이라고 판단했다.
관련기사
- 엔브렐 바이오시밀러 유럽 첫 허가…주인공은 '삼성' 2016-01-17 16:59:49





