- 제약·바이오
- 국내사
신약 개발 지원 수혜…FDA 신약 승인 역대 최다
발행날짜: 2019-02-07 12:09:13
-
가
-
59건중 34건 희귀질환 신약 차지…희귀질환 치료제·획기적 치료제 지정·우선 심사 등 지원 제도 뒷받침
지난해 미국 식품의약국(FDA)의 신약 허가건수가 역대 최다인 59건을 기록했다.
희귀의약품 지정 등 신속심사 및 허가제도의 활용으로 승인건수가 크게 증가한 것으로 분석된다.
7일 생명공학정책연구센터는 FDA CDER(의약품평가연구센터) 자료를 인용, 이같이 밝혔다.
이에 따르면 2018년 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 1996년 53건 보다 6건이 많은 승인건수로 최고기록을 경신했다.
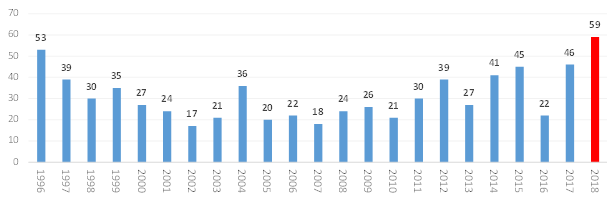
미국 FDA 신약 승인 현황(1996~2018) 및 신약 종류별 승인 현황(2008~2018)
미국 FDA의 신약 허가건수는 트럼프 정부 출범 이후 추진된 규제완화 정책으로 신약 승인이 가속화돼 2016년 22건에서 2017년 46건, 2018년 59건을 기록했다.
이는 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지하고 있다.
59건중 34건이 구루병, 파브리(Fabry) 질환, 페닐케톤뇨증(phenylketonuria) 치료제 등 희귀질환 환자 치료관련 신약이 차지했다.
승인 건수의 증가는 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약 개발 지원 제도가 뒷받침된 것으로 분석된다.
FDA 의약품평가연구센터는 신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공해 환자 치료 및 국민 건강 향상에 기여한 것으로 평가했다.
또한 희귀질환 및 전염병 등 공공성 및 미충족 욕구가 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
승인된 신약을 유형별로 보면 59건의 신약 중 32%인 19개가 First-in-class(혁신신약)로 승인됐다.
또 58%인 34개는 희귀질환(Rare Diseases) 치료제로, 73%인 43개는 하나 이상의 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)를 통해 승인받았다.
59건 중 24건은 신속심사(Fast Track)로, 14건은 획기적치료(Breakthrough therapies)로, 43건은 우선심사(Priority Review) 대상으로 지정, 4건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
또 59건 중 71%인 42건은 다른 국가에서 승인받기 전에 미국에서 최초로 승인된 약물이다.
희귀의약품 지정 등 신속심사 및 허가제도의 활용으로 승인건수가 크게 증가한 것으로 분석된다.
7일 생명공학정책연구센터는 FDA CDER(의약품평가연구센터) 자료를 인용, 이같이 밝혔다.
이에 따르면 2018년 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 1996년 53건 보다 6건이 많은 승인건수로 최고기록을 경신했다.

이는 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지하고 있다.
59건중 34건이 구루병, 파브리(Fabry) 질환, 페닐케톤뇨증(phenylketonuria) 치료제 등 희귀질환 환자 치료관련 신약이 차지했다.
승인 건수의 증가는 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약 개발 지원 제도가 뒷받침된 것으로 분석된다.
FDA 의약품평가연구센터는 신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공해 환자 치료 및 국민 건강 향상에 기여한 것으로 평가했다.
또한 희귀질환 및 전염병 등 공공성 및 미충족 욕구가 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
승인된 신약을 유형별로 보면 59건의 신약 중 32%인 19개가 First-in-class(혁신신약)로 승인됐다.
또 58%인 34개는 희귀질환(Rare Diseases) 치료제로, 73%인 43개는 하나 이상의 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)를 통해 승인받았다.
59건 중 24건은 신속심사(Fast Track)로, 14건은 획기적치료(Breakthrough therapies)로, 43건은 우선심사(Priority Review) 대상으로 지정, 4건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
또 59건 중 71%인 42건은 다른 국가에서 승인받기 전에 미국에서 최초로 승인된 약물이다.






