- 제약·바이오
- 국내사
미FDA 지난해 48개 신약 허가...노바티스 5건 최다
발행날짜: 2020-02-11 16:40:50
-
가
-
바이오항체 신약 21%로 지난 5년간 최저
희귀의약품 44% 차지...신속심사 가장 많아
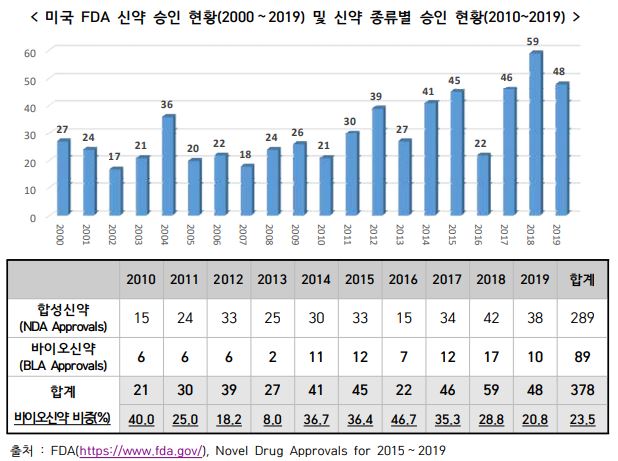
2019년 한 해 동안 미국 FDA가 허가한 신약은 총 48건으로, 2018년 59건에 비해 18.6%(11건) 감소한 것으로 조사됐다.
미국 FDA 의약품평가센터(CDER)가 2019년 한해 승인된 전문의약품 통계를 분석해 홈페이지에 공개했다.
분석 결과, 2019년 신약 허가건수는 48건으로, 역대 최다 승인건수를 기록했던 2018년 대비 18.6% 감소했다. 전년대비 감소했지만 지난 10년간(2010~2019년) 통틀어 두 번째로 많은 신약이 허가된 해로 기록된다.
이중 바이오신약은 21%를 기록했는데 이는 최근 5년간 가장 낮은 수치다. 2014년 이후 바이오신약의 비중은 평균 35%를 기록할 정도로 꾸준히 상승해 왔는데 2017년 이후 하락세를 기록중이다. 원인은 임상실패로 꼽힌다.
지난해 승인된 바이오신약은 엔허투(Enhertu), 파드셉(Padcev), 아탁베오(Adakveo), 레블로질(Reblozyl), 베오브(Beovu), 폴리비(Polivy), 스카이리지(Skyrizi), 에벤니티(Evenity), 카블리비(Cablivi), 제우브(Jeuveau) 등 10종이다.
또 48건의 신규허가 중 21건이 희귀의약품 지정을 받았는데 낭포성 섬유증, 겸상적혈구질환, 시신경척수염(neuromyelitis optica spectrum disorder), 전신경화증 관련 간질성폐질환(systemic sclerosis-associated interstitial lung disease(SSc-ILD)에 쓰이는 신약이 승인됐다.
심장, 폐, 순환기 및 내분비 질환(Heart, Lung, Circulatory, and Endocrine Diseases)에서는 트랜스티레틴 매개성 아밀로이증(transthyretin mediated amyloidosis), 정맥혈전색전증, 당뇨병 등을 치료하는 치료제가 등재됐다.
자가면역(Autoimmune Conditions) 질환에는 전신성 홍반성루프스(systemic lupus erythematosus), 비방사선학적 척추관절염(non-radiographic axial spondyloarthritis), 람베르트이튼 근무력 증후군(Lambert-Eaton myasthenic syndrome) 등의 치료제가 포함됐다.
여성/남성 특정 건강문제(Women’s and Men’s Specific Health Issues) 질환으로 여성의성욕 감소장애, 산후우울증, 남성의 성선기능저하증 치료제가 승인됐다.
신속한 개발 및승인을 촉진하기 위한 신속심사, 우선심사 등의 규제경로를 적극 활용한 것도 눈에 띈다.
48건 중 17건는 신속심사(Fast Track)로, 13건은 획기적 치료제(Breakthrough therapies)로 지정했으며, 28건은 우선심사(Priority Review), 9건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
제약사에서는 노바티스가 5건으로 가장 많은 신약을 승인받았고, 다음으로 애브비, 다이이찌산쿄, 제넨텍 등이 각각 2건을 차지했다.
미국 FDA 의약품평가센터(CDER)가 2019년 한해 승인된 전문의약품 통계를 분석해 홈페이지에 공개했다.
분석 결과, 2019년 신약 허가건수는 48건으로, 역대 최다 승인건수를 기록했던 2018년 대비 18.6% 감소했다. 전년대비 감소했지만 지난 10년간(2010~2019년) 통틀어 두 번째로 많은 신약이 허가된 해로 기록된다.
이중 바이오신약은 21%를 기록했는데 이는 최근 5년간 가장 낮은 수치다. 2014년 이후 바이오신약의 비중은 평균 35%를 기록할 정도로 꾸준히 상승해 왔는데 2017년 이후 하락세를 기록중이다. 원인은 임상실패로 꼽힌다.
또 48건의 신규허가 중 21건이 희귀의약품 지정을 받았는데 낭포성 섬유증, 겸상적혈구질환, 시신경척수염(neuromyelitis optica spectrum disorder), 전신경화증 관련 간질성폐질환(systemic sclerosis-associated interstitial lung disease(SSc-ILD)에 쓰이는 신약이 승인됐다.
심장, 폐, 순환기 및 내분비 질환(Heart, Lung, Circulatory, and Endocrine Diseases)에서는 트랜스티레틴 매개성 아밀로이증(transthyretin mediated amyloidosis), 정맥혈전색전증, 당뇨병 등을 치료하는 치료제가 등재됐다.
자가면역(Autoimmune Conditions) 질환에는 전신성 홍반성루프스(systemic lupus erythematosus), 비방사선학적 척추관절염(non-radiographic axial spondyloarthritis), 람베르트이튼 근무력 증후군(Lambert-Eaton myasthenic syndrome) 등의 치료제가 포함됐다.
여성/남성 특정 건강문제(Women’s and Men’s Specific Health Issues) 질환으로 여성의성욕 감소장애, 산후우울증, 남성의 성선기능저하증 치료제가 승인됐다.
신속한 개발 및승인을 촉진하기 위한 신속심사, 우선심사 등의 규제경로를 적극 활용한 것도 눈에 띈다.
48건 중 17건는 신속심사(Fast Track)로, 13건은 획기적 치료제(Breakthrough therapies)로 지정했으며, 28건은 우선심사(Priority Review), 9건은 가속승인(Accelerated Approval) 대상으로 지정됐다.
제약사에서는 노바티스가 5건으로 가장 많은 신약을 승인받았고, 다음으로 애브비, 다이이찌산쿄, 제넨텍 등이 각각 2건을 차지했다.






