- 제약·바이오
- 국내사
이달부터 임상 통합·신속 심사…하반기 새 정책은?
발행날짜: 2021-07-01 11:59:05
-
가
-
식약처, 의약품 안전정보 확대 등 하반기 추진 정책 공개
신약 등 재심사·의약품 재평가 온라인 업무 처리 가능
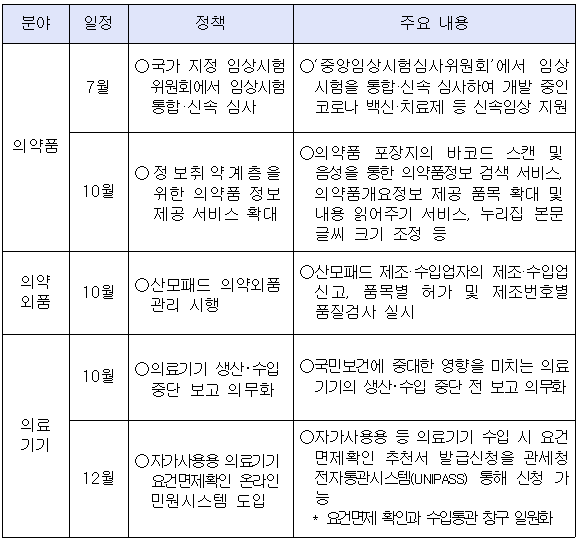
이달부터 코로나19 백신 개발 등에 신속한 임상진입을 지원하도록 국가 지정 임상시험위원회가 임상시험을 통합·신속 심사한다.
1일 식품의약품안전처는 의약품 안전정보 제공 확대로 오남용 등 안전사고 방지 정책 등 2021년 하반기부터 달라지는 의약품 정책을 공개했다.
먼저 7월부터 국산 코로나19 백신 개발을 지원하고 신속한 임상진입을 위해서 맞춤형 전주기 품질관리 상담제 실시와 함께 기존 개별임상시험위원회에서 각각 승인 심사하던 것을 '중앙임상시험심사위원회'에서 통합 심사를 시작한다.
한편 의약품 안전성 정보 송·수신 등 업무 처리를 희망하는 업체 대상으로 식약처 '의약품안전나라(nedrug.mfds.go.kr)' 시스템을 활용한 온라인 방식이 본격 도입된다.
적용 대상 업무는 ▲의약품 제조판매·수입 품목허가(신고)의 갱신 ▲신약 등의 재심사 ▲의약품등 재평가 ▲안전성·유효성에 관한 자료 검토(통일조정) ▲안전성 정보 보고 ▲의약품의 적정사용 정보 제공을 위한 안전성과 효능·효과 등에 대한 평가(DUR) 등 총 6종이다.
이전에는 식약처 담당 부서가 행정 절차마다 업체에 등기우편으로 관련 공문서를 송달했으나, 이달부터 온라인 방식을 희망한 업체는 '의약품안전나라'를 통해 온라인 수신과 의견 제출이 가능해진다.
10월에는 정보취약계층을 위한 의약품 정보제공 서비스가 확대된다.
의약품 정보 접근성이 떨어지는 계층을 위해 의약품 포장지의 바코드 스캔 및 음성을 통한 의약품정보 검색 서비스가 지원되고, 의약품개요정보 제공 품목 확대 및 내용 읽어주기 서비스, 누리집 본문 글씨 크기 조정 등이 추진된다.
생활 속 안전 사각지대 해소를 위해 출산 직후 사용하는 '산모패드'를 의약외품으로 신규 지정·관리하고, 온라인 민원 시스템을 구축해 '자가사용‧구호목적‧기타 긴급도입 필요 의료기기' 수입 시 요건면제확인 민원을 손쉽게 신청할 수 있는 방안도 추진된다.
오는 10월부터 산모패드를 제조‧수입하는 업체는 사전에 제조‧수입신고와 함께 품목별 허가를 받아야 하고 제조번호별 품질검사를 실시해 적합한 제품만을 출고해야 한다.
아울러, 자가사용용·구호용 등으로 의료기기를 수입 할 때 필요한 '요건면제확인 추천서'를 12월부터는 관세청 전자통관시스템(유니패스)을 통해 온라인으로 신청 가능할 수 있다.
2021년 하반기 식의약품 주요 안전정책 추진 일정
1일 식품의약품안전처는 의약품 안전정보 제공 확대로 오남용 등 안전사고 방지 정책 등 2021년 하반기부터 달라지는 의약품 정책을 공개했다.
먼저 7월부터 국산 코로나19 백신 개발을 지원하고 신속한 임상진입을 위해서 맞춤형 전주기 품질관리 상담제 실시와 함께 기존 개별임상시험위원회에서 각각 승인 심사하던 것을 '중앙임상시험심사위원회'에서 통합 심사를 시작한다.
한편 의약품 안전성 정보 송·수신 등 업무 처리를 희망하는 업체 대상으로 식약처 '의약품안전나라(nedrug.mfds.go.kr)' 시스템을 활용한 온라인 방식이 본격 도입된다.
적용 대상 업무는 ▲의약품 제조판매·수입 품목허가(신고)의 갱신 ▲신약 등의 재심사 ▲의약품등 재평가 ▲안전성·유효성에 관한 자료 검토(통일조정) ▲안전성 정보 보고 ▲의약품의 적정사용 정보 제공을 위한 안전성과 효능·효과 등에 대한 평가(DUR) 등 총 6종이다.
이전에는 식약처 담당 부서가 행정 절차마다 업체에 등기우편으로 관련 공문서를 송달했으나, 이달부터 온라인 방식을 희망한 업체는 '의약품안전나라'를 통해 온라인 수신과 의견 제출이 가능해진다.
10월에는 정보취약계층을 위한 의약품 정보제공 서비스가 확대된다.
의약품 정보 접근성이 떨어지는 계층을 위해 의약품 포장지의 바코드 스캔 및 음성을 통한 의약품정보 검색 서비스가 지원되고, 의약품개요정보 제공 품목 확대 및 내용 읽어주기 서비스, 누리집 본문 글씨 크기 조정 등이 추진된다.
생활 속 안전 사각지대 해소를 위해 출산 직후 사용하는 '산모패드'를 의약외품으로 신규 지정·관리하고, 온라인 민원 시스템을 구축해 '자가사용‧구호목적‧기타 긴급도입 필요 의료기기' 수입 시 요건면제확인 민원을 손쉽게 신청할 수 있는 방안도 추진된다.
오는 10월부터 산모패드를 제조‧수입하는 업체는 사전에 제조‧수입신고와 함께 품목별 허가를 받아야 하고 제조번호별 품질검사를 실시해 적합한 제품만을 출고해야 한다.
아울러, 자가사용용·구호용 등으로 의료기기를 수입 할 때 필요한 '요건면제확인 추천서'를 12월부터는 관세청 전자통관시스템(유니패스)을 통해 온라인으로 신청 가능할 수 있다.
관련기사
- 8400억 '마중물'…대규모 첨단재생의료 지원책 공개 2021-06-04 16:39:52
- 코로나19부터 마약류까지…새해 바뀌는 의약품 정책은? 2021-01-01 11:54:43
- 제네릭 신뢰 정책 헛다리만…"규제 완화는 틀렸다" 2020-06-27 05:00:59
- 의약품 전문 포털 문연다, 허가·안전·특허 정보 한눈에 2019-01-25 12:00:14






