- 제약·바이오
- 국내사
1조원 급여 재평가 속 학회 '입김'이 제약사 운명 좌우
-
가
-
복지부‧심평원, 건정심 확정 평가계획 공고하고 본격 돌입
임상적 유용성 우선시하기로…제약사들 연구문헌 수집 분주
병‧의원 처방 규모만 한 해 1조원에 가까운 기등재 의약품에 대한 '급여 재평가' 작업이 본격 시작됐다.
이 가운데 급여 재평가 과정에서 학회의 의견도 중요한 평가 잣대로 작용할 전망이다.
8일 제약업계에 따르면, 보건복지부와 건강보험심사평가주은 최근 건강보험정책심의위원회에서 최종 확정한 2022년, 2023년 급여 적정성 평가 계획을 공고했다.
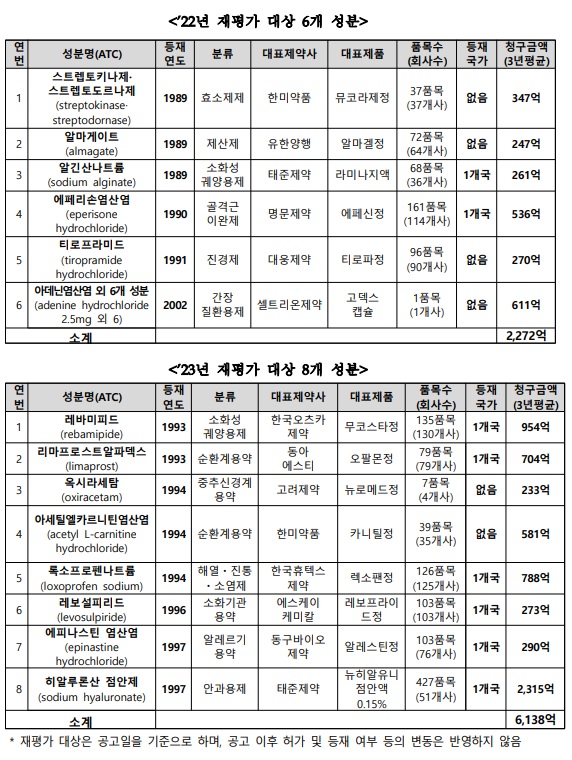
올해 재평가 대상 성분은 ▲스렙토키나제·스트렙토도르나제(streptokinase-streptodornase) ▲알마게이트(almagate) ▲알긴산나트륨(sodium alginate) ▲에페리손염산염(eperisone hydrochloride) ▲티로프라미드염산염(tiroprimide hydrochloride) ▲오로트산카르니틴(고덱스)다.
내년 재평가 대상 성분은 ▲레바미피드(rebamipide) ▲리마프로스트알파덱스(limaprost α-cyclodextrin) ▲옥시라세탐(oxiracetam) ▲아세틸엘카르니틴염산염(acetyl L-carnitine hydrochloride) ▲록소프로펜나트륨(loxoprofen sodium) ▲레보설피리드(levosulpiride) ▲에피나스틴염산염(epinastine hydrochloride) ▲히알루론산나트륨(sodium hyaluronate) 점안제 등이다.
해당 성분을 대상으로 복지부와 심평원은 임상적 유용성을 집중적으로 살필 예정이다.
여기서 임상적 유용성은 주요 진료과목 교과서, 임상진료지침, HTA(Health Technology Assessment) 보고서, 임상연구 문헌 등이 검토 대상이다.
구체적으로 교과서와 임상진료지침은 관련 성분을 주 처방하는 주요 진료과목 학회가 추천하는 것이 대상이 된다.
다만, 교과서 및 임상진료지침은 최근 5년 이내 발간된 자료에서 선정함을 원칙으로 한다.
HTA 보고서는 정부 관련 또는 비영리 기관 수행 평가 보고서와 Cochrane 자료 등이 주요 토대다.
임상연구문헌은 SCI, SCIE 등재 학술지에 게재된 RCT 문헌을 검토하되, 항암제, 희귀질환 등 RCT 수행이 명백하게 어려운 약제에 대해서는 문헌 선택의 범주 확대 적용이 가능하다.
하지만 심평원은 재평가 과정에서 초록만 발표된 연구, 증례보고 및 예비연구, 학술지 미게재 된 연구 등은 임상적 유용성 평가 임상연구문헌 대상에서 제외한다는 방침인 것으로 전해졌다.
결국 급여 재평가 과정에서 학회 등이 제시하는 임상진료지침과 연구문헌 등을 우선시해 급여 지속 여부를 따져보겠다는 것이다.
사실상 제약사 입장에서는 주요 진료과목 학회와의 적극적인 의견 교환과 협조가 필수가 된 셈이다.
익명을 요구한 한 국내사 임원은 "심평원이 관련 제약사와의 급여 재평가 관련 의견수렴 과정에서 임상적 유용성을 가장 우선시 해 평가하겠다는 방침을 내놨다"며 "결국 학회의 임상진료지침과 관련 연구논문이 핵심이 될 것"이라고 내다봤다.
그는 "자체적으로는 임상적 유용성을 증명할 만한 임상진료지침과 관련 연구논문을 모으는 데 주력하고 있다"며 "관련 학회와도 의견을 공유해 평가에 대응한다는 계획"이라고 전했다.
관련기사
- 임상 재평가 도마 오른 간장약…전문약 시장 위기론 2022-03-02 05:30:00
- 심평원, 제약사 자료제출 급증 "병‧의원 시스템 활용" 2022-02-28 13:40:51
- 1조원 재평가 약물 확정…키트루다 폐암 확대 성공 2022-02-25 19:19:25
- 복지부-제약사 '콜린' 법적 씨름 속 정당성 확보 경쟁 2022-02-15 11:54:40






