- 제약·바이오
- 국내사
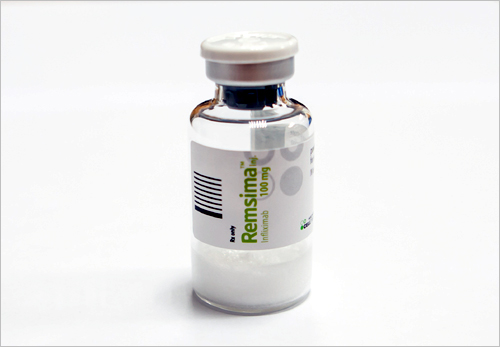
셀트리온 '램시마' 유럽 EMA 허가 잭팟
세계 첫 항체 바이오시밀러 승인…28조 시장 본격 공략

이석준 기자
기사입력: 2013-06-29 06:35:33
-
가
셀트리온 세계 첫 항체 바이오시밀러 '램시마(레미케이드 복제약)'가 28일 유럽 EMA(유럽의약품청) 허가를 받았다.
이로써 셀트리온은 EU 27개국과 EEA(유럽경제지역) 3개국 등 총 30개국에서 별도 허가승인 절차없이 행정 절차만으로 '램시마' 판매허가를 받을 수 있게 됐다.
'램시마'가 28조원 규모의 TNF-알파 억제 항체치료제 시장 경쟁에 본격 나서게 된 것이다.
셀트리온 김형기 부사장은 이날 기자간담회에서 "램시마 EMA 허가는 제약산업에서 꿈꾸는 핵무기를 장착한 것이나 다름없다"고 흥분을 감추지 못했다.
그러면서 "램시마 공략 시장은 28조원 규모다. 국내 제약산업 총 규모의 2배에 달한다. '램시마'가 시장점유율 10%만 차지해도 3조원이라는 매출이 가능하다는 계산이 나온다"고 덧붙였다.
'램시마'는 강직성 척추염, 류마티스 관절염에 대한 글로벌 임상 1상 및 3상을 통해 대조약 '레미케이드'와 안전성과 유효성 측면에서 동등성을 입증했다.
이를 토대로 EMA로부터 대조약과 같은 류마티스 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선성 관절염, 소아크론병 등 모든 적응증에 대해서 외삽을 인정받았다.
램시마 글로벌임상시험 책임연구자 한양대학교병원 유대현 교수는 "램시마는 개발단계와 임상시험에서 오리지널과 동등성을 공고히 입증했기 때문에 EMA로부터 모든 적응증을 인정받았다"고 설명했다.
이어 "때문에 오리지널과 동등하게 환자에 처방하는데 문제가 없다고 생각된다. 램시마가 더 많은 환자에게 치료기회를 제공할 수 있을 것"이라며 국내 처방 확대를 예고했다.
이로써 셀트리온은 EU 27개국과 EEA(유럽경제지역) 3개국 등 총 30개국에서 별도 허가승인 절차없이 행정 절차만으로 '램시마' 판매허가를 받을 수 있게 됐다.
'램시마'가 28조원 규모의 TNF-알파 억제 항체치료제 시장 경쟁에 본격 나서게 된 것이다.

그러면서 "램시마 공략 시장은 28조원 규모다. 국내 제약산업 총 규모의 2배에 달한다. '램시마'가 시장점유율 10%만 차지해도 3조원이라는 매출이 가능하다는 계산이 나온다"고 덧붙였다.
'램시마'는 강직성 척추염, 류마티스 관절염에 대한 글로벌 임상 1상 및 3상을 통해 대조약 '레미케이드'와 안전성과 유효성 측면에서 동등성을 입증했다.
이를 토대로 EMA로부터 대조약과 같은 류마티스 관절염, 강직성 척추염, 크론병, 궤양성 대장염, 건선성 관절염, 소아크론병 등 모든 적응증에 대해서 외삽을 인정받았다.
램시마 글로벌임상시험 책임연구자 한양대학교병원 유대현 교수는 "램시마는 개발단계와 임상시험에서 오리지널과 동등성을 공고히 입증했기 때문에 EMA로부터 모든 적응증을 인정받았다"고 설명했다.
이어 "때문에 오리지널과 동등하게 환자에 처방하는데 문제가 없다고 생각된다. 램시마가 더 많은 환자에게 치료기회를 제공할 수 있을 것"이라며 국내 처방 확대를 예고했다.

관련기사
- 셀트리온, 28조 시장서 잭팟 터트릴까 2012-07-23 11:50:00









