- 병·의원
- 대학병원
암세포 성장 새로운 신호전달체계 밝혀냈다
대식세포에 의한 암 성장·혈관생성 조절 신호전달 체계 발견

이지현 기자
기사입력: 2015-03-09 12:16:04
-
가
국내 의료진이 암 조직 내 대식세포가 어떤 과정을 통해 암세포가 성장하는지 밝혀내 눈길을 끌고 있다.
이는 정상세포까지 파괴하는 기존 항암제의 한계를 넘어 암세포 성장을 억제하는 새로운 치료제 개발의 중요한 단서를 제공할 것으로 기대된다.
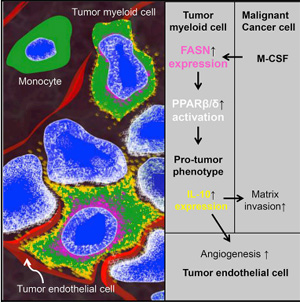
서울대병원 이상언, 김효수 교수 연구팀(순환기내과)은 대식세포의 PPARdelta(퍼옥시즘 증강제 활성화 수용체 델타)라는 전사인자가 암세포에 의해 활성화되면 암세포 제거 임무를 띤 대식세포가 오히려 암세포 성장을 돕는다는 사실을 발견했다고 9일 밝혔다.
이에 따라 대식세포의 PPARdelta를 차단하면 암세포 성장이 억제됨을 증명했다.
연구팀은 PPARdelta 미발현 생쥐의 골수를 정상 생쥐에 이식해 대식세포에서만 특이적으로 PPARdelta가 발현되지 않는 생쥐(실험군)을 만들었다.
이어 PPARdelta 발현 생쥐의 골수를 정상 생쥐에 이식해 대식세포에서도 PPARdelta가 발현되는 생쥐(대조군)을 만들어 두 군에 폐암세포를 이식했다.
이식 2주째 암세포의 크기를 분석한 결과, PPARdelta가 없는 실험군에서는 107.94㎣인 반면, PPARdelta가 있는 대조군에서는 229.45 ㎣로 나타났다.
암세포의 무게도 실험군에서는 45mg인 반면, 대조군에서는 122.2mg로 나타났다.
연구팀은 두 군의 암세포를 떼어내 조직검사를 한 결과, 혈관에 의해 영양과 산소공급이 되지 않을 때 생기는 세포 괴사 부위가 실험군이 대조군에 비해 더 크게 나타났다.
암세포의 혈관 밀집도를 분석한 결과, 실험군이 대조군에 비해 암세포 내에 혈관이 더 적게 형성됐다.
이렇게 PPARdelta가 없는 경우에 암조직의 성장이 저해된다는 것은 암조직의 성장에 PPARdelta가 필수적이라는 것이다.
그 기전을 규명한 결과, 폐암세포에서 발현되는 M-CSF가 주변 대식세포의 'Fatty acid synthase'라는 효소의 발현을 증가시키고 PPARdelta를 활성화시킨다.
그 결과 대식세포에서는 IL-10이라는 사이토카인을 생산해 암세포의 이동과 혈관 생성을 촉진시키는 것을 밝혔다.
이에 대해 김효수 교수는 "본 연구는 대식세포가 암의 성장과 혈관 생성을 촉진하는 핵심신호전달 체계를 밝히고, 이를 차단하면 암 성장을 억제할 수 있다는 것을 보여줌으로써 암 치료에서 새로운 타깃을 발견했다는 의의를 갖는다"고 설명했다.
대식세포(macrophage)란, 암세포는 주변에 있는 정상 세포들로부터 도움을 받아 빠르게 자라고 전이도 일으키는 데 이 과정에서 암세포를 돕는 핵심 세포 중 하나다.
정상적인 대식세포는 외부 침입 균을 제거하는 역할을 하며, 암세포가 생겨도 이를 인지하고 제거해야 한다. 하지만 암세포에 길들여지면 암세포의 생존과 이동, 영양 공급에 중요한 혈관 생성을 촉진시킨다.
대식세포가 우리 몸을 보호하는 역할을 저버리고 암세포의 성장을 돕는 '배신'을 일으키는 기전은, 암 치료의 새로운 타깃으로서 국제적으로 활발하게 연구가 이뤄지고 있다.
PPARdelta 촉진제는 기존에 대사질환의 치료제로서 세계적인 제약회사인 GSK에 의해 개발되었다가 암의 발생을 증가시킬 수 있다는 우려가 제기 되면서 중단됐다.
이번 연구는 PPARdelta에 의한 암 발생 기전을 밝힘으로써 이러한 부작용을 피하고 PPARdelta 활성의 긍정적인 면을 부각시키는 신약제의 필요성에 대한 논리적 근거를 제공했다는 평가를 받는다.
이는 정상세포까지 파괴하는 기존 항암제의 한계를 넘어 암세포 성장을 억제하는 새로운 치료제 개발의 중요한 단서를 제공할 것으로 기대된다.

이에 따라 대식세포의 PPARdelta를 차단하면 암세포 성장이 억제됨을 증명했다.
연구팀은 PPARdelta 미발현 생쥐의 골수를 정상 생쥐에 이식해 대식세포에서만 특이적으로 PPARdelta가 발현되지 않는 생쥐(실험군)을 만들었다.
이어 PPARdelta 발현 생쥐의 골수를 정상 생쥐에 이식해 대식세포에서도 PPARdelta가 발현되는 생쥐(대조군)을 만들어 두 군에 폐암세포를 이식했다.
이식 2주째 암세포의 크기를 분석한 결과, PPARdelta가 없는 실험군에서는 107.94㎣인 반면, PPARdelta가 있는 대조군에서는 229.45 ㎣로 나타났다.
암세포의 무게도 실험군에서는 45mg인 반면, 대조군에서는 122.2mg로 나타났다.
연구팀은 두 군의 암세포를 떼어내 조직검사를 한 결과, 혈관에 의해 영양과 산소공급이 되지 않을 때 생기는 세포 괴사 부위가 실험군이 대조군에 비해 더 크게 나타났다.
암세포의 혈관 밀집도를 분석한 결과, 실험군이 대조군에 비해 암세포 내에 혈관이 더 적게 형성됐다.
이렇게 PPARdelta가 없는 경우에 암조직의 성장이 저해된다는 것은 암조직의 성장에 PPARdelta가 필수적이라는 것이다.
그 기전을 규명한 결과, 폐암세포에서 발현되는 M-CSF가 주변 대식세포의 'Fatty acid synthase'라는 효소의 발현을 증가시키고 PPARdelta를 활성화시킨다.
그 결과 대식세포에서는 IL-10이라는 사이토카인을 생산해 암세포의 이동과 혈관 생성을 촉진시키는 것을 밝혔다.
이에 대해 김효수 교수는 "본 연구는 대식세포가 암의 성장과 혈관 생성을 촉진하는 핵심신호전달 체계를 밝히고, 이를 차단하면 암 성장을 억제할 수 있다는 것을 보여줌으로써 암 치료에서 새로운 타깃을 발견했다는 의의를 갖는다"고 설명했다.
대식세포(macrophage)란, 암세포는 주변에 있는 정상 세포들로부터 도움을 받아 빠르게 자라고 전이도 일으키는 데 이 과정에서 암세포를 돕는 핵심 세포 중 하나다.
정상적인 대식세포는 외부 침입 균을 제거하는 역할을 하며, 암세포가 생겨도 이를 인지하고 제거해야 한다. 하지만 암세포에 길들여지면 암세포의 생존과 이동, 영양 공급에 중요한 혈관 생성을 촉진시킨다.
대식세포가 우리 몸을 보호하는 역할을 저버리고 암세포의 성장을 돕는 '배신'을 일으키는 기전은, 암 치료의 새로운 타깃으로서 국제적으로 활발하게 연구가 이뤄지고 있다.
PPARdelta 촉진제는 기존에 대사질환의 치료제로서 세계적인 제약회사인 GSK에 의해 개발되었다가 암의 발생을 증가시킬 수 있다는 우려가 제기 되면서 중단됐다.
이번 연구는 PPARdelta에 의한 암 발생 기전을 밝힘으로써 이러한 부작용을 피하고 PPARdelta 활성의 긍정적인 면을 부각시키는 신약제의 필요성에 대한 논리적 근거를 제공했다는 평가를 받는다.

병·의원 기사
- "바쁘다 바빠" 다음 행선지는? 2015-03-11 05:30:00
- 동아대병원, 수술전문센터로 '변신 중' 2015-03-10 05:40:57
- 조인성 후보, 개원의 등 4대 직역별 맞춤공약 제시 2015-03-09 12:04:53
- "허혈성쇼크 환자에 팔뚝 내준 송후빈, 의료계도 살린다" 2015-03-09 12:03:11
- 시민단체 "쉐도우 닥터 우리가 직접 적발하겠다" 2015-03-09 09:40:12









