- 제약·바이오
- 국내사
상반기 제네릭 생동승인 활발…전년 대비 49% ↑
아픽사반 등 재심사 또는 특허 만료예정 의약품 개발 집중

최선 기자
기사입력: 2017-08-30 11:55:52
-
가
올해 상반기 제네릭의약품 허가를 위한 생물학적동등성 시험 계획 승인 건수는 70건으로 전년 동기 대비 약 49% 증가했다.
특히 재심사나 특허 만료 예정 품목 에 대한 제네릭의약품 생동성 승인이 과반을 넘겨 제네릭 개발은 재심사 또는 특허 만료예정 의약품에 집중돼 있었다.
30일 식품의약품안전처 식품의약품안전평가원은 2017년 상반기 제네릭의약품 허가를 위한 생물학적동등성 시험 계획 승인 건수는 70건으로 지난해 상반기(47건)에 대비 약 49% 증가했다고 밝혔다.
연도별 상반기 생동성시험계획 승인건수는 2012년(108건)에서 2013년(79건), 2014년(76건), 2015년(51건), 2016년(47건), 2017년(70건)이었다.
승인된 생동성시험의 주요 특징은 ▲재심사 또는 특허 만료예정 의약품 개발 집중 ▲치료영역별로 대사성의약품, 중추신경계용의약품 개발 여전히 활발 등이다.
올해 상반기에 승인된 70건 중 재심사나 특허 만료 예정 품목 에 대한 제네릭의약품 생동성 승인은 40건(57.1%)을 차지했다.
재심사·특허 만료 예정 의약품 관련 생동성 시험 비율은 2015년 63.0%에서 2016년 59.6%, 2017년 57.1%를 기록했다.
성분별로는 당뇨병성 다발성 신경염 완화에 사용되는 알티옥트산트로메타민염(13건)과 심혈관치료제 아픽사반(4건) 등 만성질환 치료에 사용하는 의약품의 개발이 증가했다.
이는 올해 재심사 만료(2017.11.20) 예정으로 시장성이 높은 당뇨병 관련 치료제 알티옥트산트로메타민염과 심혈관계 치료제 아픽사반 등의 개발이 활성화된데 따른 것으로 분석된다.
실제로 알티옥트산트로메타민염관련 승인 건수는 2016년 1건(0.8%)에서 2017년 상반기 13건(21.4%)으로 껑충 뛰었다. 아픽사반 역시 2016년 1건(0.8%)에서 2017년 상반기 4건(5.7%)으로 증가했다.
알티옥트산트로메타민염 생산실적은 28.1억원(2014년)에서 74.4억원(2015년), 122.7억원(2016년)이었다.
재심사·특허 만료 예정 품목 중 고령화, 식이변화 등의 영향으로 당뇨병 관련 치료제(23건), 심혈관계 치료제(6건)와 같은 만성질환 치료제가 높은 비중(29건 72.5%)을 차지했다.
당뇨병 관련 치료제 승인은 2015년 2건, 2016년 21건, 2017년 상반기 23건을, 심혈관계 치료제는 2015년 49건, 2016년 20건, 2017년 상반기 6건이었다.
2016년에 이어 재심사 만료예정 의약품인 당뇨병치료제 리나글립틴/메트포르민 복합제(2017.9)와 특허 만료예정 의약품인 비염치료제 베포타스틴베실산염(2017.12)에 대한 제네릭의약품도 꾸준히 개발되고 있는 것으로 나타났다.
리나글립틴/메트포르민염산염(단일제 포함) 승인 건수는 2016년 18건(14.7%), 2017년 상반기 6건(8.6%)이었고 베포타스틴베실산염은 2016년 15건(12.2%)에서 2017년 상반기 3건(4.3%)이었다.
치료영역별로 보면 대사성의약품, 중추신경계용의약품 개발이 활발했다.
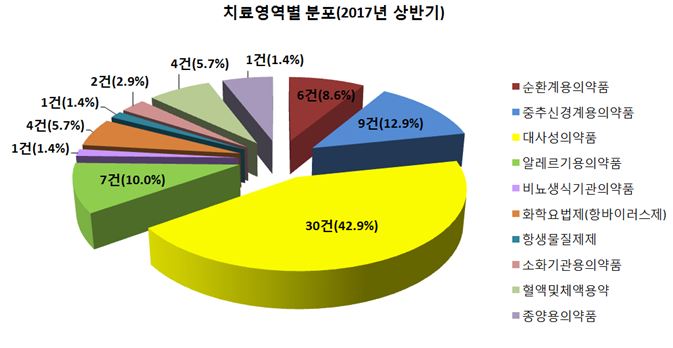
2017년 상반기 치료영역별 승인건수는 당뇨병치료제 등 대사성의약품(30건, 42.9%), 우울증 등에 사용하는 중추신경계용의약품(9건, 12.9%)의 개발 건수가 전체의 절반 이상(39건, 55.8%)을 차지했으며, 알레르기용의약품(7건, 10.0%), 순환계용의약품(6건, 8.6%) 등이 뒤를 이었다.
대사성의약품으로는 당뇨병성 다발성 신경염의 완화에 사용되는 알티옥트산트로메타민염(13건) 당뇨병치료제인 리나글립틴/메트포르민염산염(5건) 개발이 집중됐다.
중추신경계의약품은 고령화와 스트레스 등의 영향으로 매년 꾸준히 개발이 이뤄지고 있으며, 우울증 치료제 미르타자핀, 쿠에티아핀푸마르산염과 파킨슨병 치료제인 로피니롤염산염이 각각 2건 승인됐다.
특히 재심사나 특허 만료 예정 품목 에 대한 제네릭의약품 생동성 승인이 과반을 넘겨 제네릭 개발은 재심사 또는 특허 만료예정 의약품에 집중돼 있었다.
30일 식품의약품안전처 식품의약품안전평가원은 2017년 상반기 제네릭의약품 허가를 위한 생물학적동등성 시험 계획 승인 건수는 70건으로 지난해 상반기(47건)에 대비 약 49% 증가했다고 밝혔다.
연도별 상반기 생동성시험계획 승인건수는 2012년(108건)에서 2013년(79건), 2014년(76건), 2015년(51건), 2016년(47건), 2017년(70건)이었다.
승인된 생동성시험의 주요 특징은 ▲재심사 또는 특허 만료예정 의약품 개발 집중 ▲치료영역별로 대사성의약품, 중추신경계용의약품 개발 여전히 활발 등이다.
올해 상반기에 승인된 70건 중 재심사나 특허 만료 예정 품목 에 대한 제네릭의약품 생동성 승인은 40건(57.1%)을 차지했다.
재심사·특허 만료 예정 의약품 관련 생동성 시험 비율은 2015년 63.0%에서 2016년 59.6%, 2017년 57.1%를 기록했다.
성분별로는 당뇨병성 다발성 신경염 완화에 사용되는 알티옥트산트로메타민염(13건)과 심혈관치료제 아픽사반(4건) 등 만성질환 치료에 사용하는 의약품의 개발이 증가했다.

실제로 알티옥트산트로메타민염관련 승인 건수는 2016년 1건(0.8%)에서 2017년 상반기 13건(21.4%)으로 껑충 뛰었다. 아픽사반 역시 2016년 1건(0.8%)에서 2017년 상반기 4건(5.7%)으로 증가했다.
알티옥트산트로메타민염 생산실적은 28.1억원(2014년)에서 74.4억원(2015년), 122.7억원(2016년)이었다.
재심사·특허 만료 예정 품목 중 고령화, 식이변화 등의 영향으로 당뇨병 관련 치료제(23건), 심혈관계 치료제(6건)와 같은 만성질환 치료제가 높은 비중(29건 72.5%)을 차지했다.
당뇨병 관련 치료제 승인은 2015년 2건, 2016년 21건, 2017년 상반기 23건을, 심혈관계 치료제는 2015년 49건, 2016년 20건, 2017년 상반기 6건이었다.
2016년에 이어 재심사 만료예정 의약품인 당뇨병치료제 리나글립틴/메트포르민 복합제(2017.9)와 특허 만료예정 의약품인 비염치료제 베포타스틴베실산염(2017.12)에 대한 제네릭의약품도 꾸준히 개발되고 있는 것으로 나타났다.
리나글립틴/메트포르민염산염(단일제 포함) 승인 건수는 2016년 18건(14.7%), 2017년 상반기 6건(8.6%)이었고 베포타스틴베실산염은 2016년 15건(12.2%)에서 2017년 상반기 3건(4.3%)이었다.
치료영역별로 보면 대사성의약품, 중추신경계용의약품 개발이 활발했다.
2017년 상반기 치료영역별 승인건수는 당뇨병치료제 등 대사성의약품(30건, 42.9%), 우울증 등에 사용하는 중추신경계용의약품(9건, 12.9%)의 개발 건수가 전체의 절반 이상(39건, 55.8%)을 차지했으며, 알레르기용의약품(7건, 10.0%), 순환계용의약품(6건, 8.6%) 등이 뒤를 이었다.
대사성의약품으로는 당뇨병성 다발성 신경염의 완화에 사용되는 알티옥트산트로메타민염(13건) 당뇨병치료제인 리나글립틴/메트포르민염산염(5건) 개발이 집중됐다.
중추신경계의약품은 고령화와 스트레스 등의 영향으로 매년 꾸준히 개발이 이뤄지고 있으며, 우울증 치료제 미르타자핀, 쿠에티아핀푸마르산염과 파킨슨병 치료제인 로피니롤염산염이 각각 2건 승인됐다.

관련기사
- "돈 되는 제네릭에 집중" 리나글립틴 개발 최다 2017-02-21 11:44:25
- 다국적제약사 특허·임상 압도…국내사 아직 역부족 2017-07-08 05:30:53
- 품목·임상·특허로 알아본 국내 제약사 성적표는 2017-01-04 05:00:55
- 특허종료 앞둔 '시알리스' 제네릭 개발 인기 '후끈' 2015-02-05 11:57:59









