- 제약·바이오
- 국내사
리피딜·콜립 등 중성지방치료제 쇼크·부종 주의보
식약처, 국내외 사례 종합 주의사항 변경 예고

최선 기자
기사입력: 2019-03-28 12:00:50
-
가
이상지질혈증 치료제 성분 페노피브레이트에 과민증 주의사항이 추가된다.
최근 식품의약품안전처는 미국 식품의약품청(FDA) 안전성 정보와 국내외 허가 현황, 제출의견 등을 종합 검토한 결과를 토대로 허가사항을 변경할 예정이다.
먼저 일반적 주의 사항에 급성 과민증 관련 내용이 신설된다. 구체적으로 아나필락시스 및 혈관부종이다.
아울러 일부 사례에서는 과민반응으로 인한 생명위험과 응급치료가 필요했으며 환자에게 급성 과민반응의 증상이나 증후가 나타날 경우 즉각 진찰을 받고 이 약의 투여를 중지해야 한다는 내용도 추가될 예정이다.
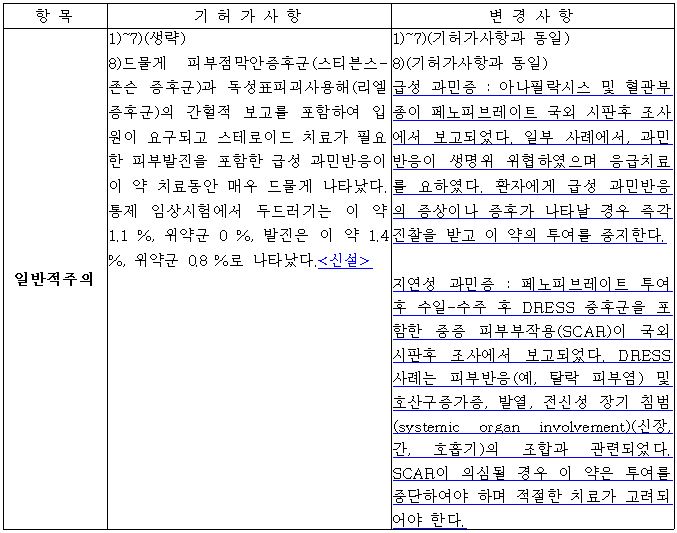
지연성 과민증도 보고됨에 됨에 따라 관련 내용도 추가된다.
페노피브레이트 투여 후 수일-수주 후 과민반응증후군(DRESS 증후군)을 포함한 중증 피부부작용(SCAR)이 국외 시판후 조사에서 보고됐다.
DRESS 사례는 탈락 피부염 등 피부반응 및 호산구증가증, 발열, 신장, 간, 호흡기에 대한 전신성 장기 침범(systemic organ involvement)과 관련됐다. SCAR가 의심될 경우 이 약은 투여를 중단해야 하며 적절한 치료가 고려돼야 한다.
페노피브레이트 품목은 단일 성분 제제 26개, 페노피브레이트/심바스타틴 복합제 2개, 페노피브레이트/프라바스타틴 복합제 2개까지 총 30 품목이다.
녹십자 리피딜슈프라정, 한미약품 페노시드캡슐, 한국애보트 콜립정, 유영제약 프라바페닉스 등이 포함됐다.
식약처는 4월 10일까지 의견을 접수, 11일 허가사항을 변경한다는 방침이다.
최근 식품의약품안전처는 미국 식품의약품청(FDA) 안전성 정보와 국내외 허가 현황, 제출의견 등을 종합 검토한 결과를 토대로 허가사항을 변경할 예정이다.
먼저 일반적 주의 사항에 급성 과민증 관련 내용이 신설된다. 구체적으로 아나필락시스 및 혈관부종이다.
아울러 일부 사례에서는 과민반응으로 인한 생명위험과 응급치료가 필요했으며 환자에게 급성 과민반응의 증상이나 증후가 나타날 경우 즉각 진찰을 받고 이 약의 투여를 중지해야 한다는 내용도 추가될 예정이다.

페노피브레이트 투여 후 수일-수주 후 과민반응증후군(DRESS 증후군)을 포함한 중증 피부부작용(SCAR)이 국외 시판후 조사에서 보고됐다.
DRESS 사례는 탈락 피부염 등 피부반응 및 호산구증가증, 발열, 신장, 간, 호흡기에 대한 전신성 장기 침범(systemic organ involvement)과 관련됐다. SCAR가 의심될 경우 이 약은 투여를 중단해야 하며 적절한 치료가 고려돼야 한다.
페노피브레이트 품목은 단일 성분 제제 26개, 페노피브레이트/심바스타틴 복합제 2개, 페노피브레이트/프라바스타틴 복합제 2개까지 총 30 품목이다.
녹십자 리피딜슈프라정, 한미약품 페노시드캡슐, 한국애보트 콜립정, 유영제약 프라바페닉스 등이 포함됐다.
식약처는 4월 10일까지 의견을 접수, 11일 허가사항을 변경한다는 방침이다.

제약·바이오 기사
- 국산 신약 케이캡 에소메프라졸과 어깨 나란히 2019-03-28 06:00:50
- 9가 HPV 백신 한국인 효과 합격 NIP 진입 '청신호' 2019-03-28 06:00:48
- 갈팡질팡 제네릭 약가제도에 우려하는 제약업계 2019-03-27 14:23:45
- 3기 폐암 더발루맙 사용 "항암방사선 대안" 2019-03-27 12:51:28
- 35세 이상 흡연 여성, 복합경구피임약 복용 금지 2019-03-27 11:41:37









