- 제약·바이오
- 국내사
첨바법 시행 임박...유전자치료제 장기추적조사 의무화
발행날짜: 2020-06-26 11:56:27
-
가
-
식약처, 7월 하반기부터 달라지는 주요 시행 정책 공개
첨단바이오의약품·혁신의료기기 안전관리 체계 시행
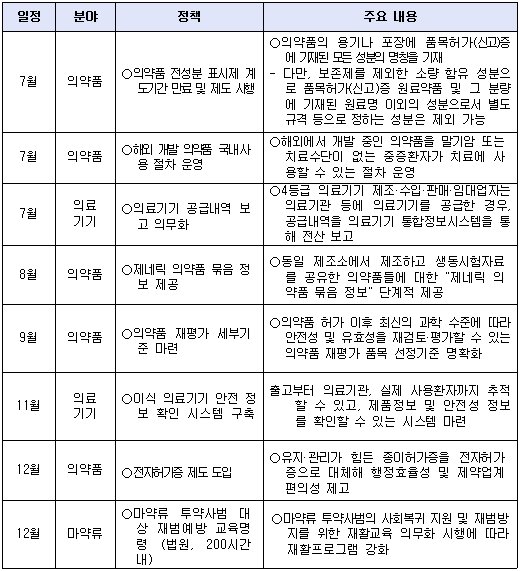
8월 첨단재생바이오법이 시행됨에 따라 투약환자에 대한 장기추적조사를 의무화하는 등 새 정책들이 시행된다.
26일 식품의약품안전처는 식품‧의약품 등의 안전관리와 관련해 '올해 하반기 달라지는 식품·의약품 주요 정책'을 공개했다.
먼저 유전자치료제 등 첨단바이오의약품에 대한 안전관리를 강화하고 신속한 제품화를 지원하는 '첨단재생바이오법'이 8월 28일 시행됨에 따라 인체세포등 관리업을 신설하고 투약환자에 대한 장기추적조사를 의무화하는 등 맞춤형 관리체계를 시행한다.
바이오의약품은 살아있는 세포·조직 또는 유전자를 원료로 제조한 것으로 세포치료제, 유전자치료제, 조직공학제제 등이 이에 포함된다.
또 의료기기 분야도 지난 5월 1일 '의료기기산업육성 및 혁신의료기기지원법' 시행에 따라 혁신의료기기 지정 및 인허가 특례 등 새로운 제도 운영이 본격화 되고 국민에게 새로운 치료기회를 빠르게 적용할 수 있을 것으로 기대된다.
의료기기 허가부터 유통·사용까지 전주기 안전관리를 위해 의료기관 등에 의료기기를 공급하는 제조·수입·판매·임대업자에 대해 의료기기 공급내역을 보고하는 방안도 추진된다.
시행 시기는 7월. 4등급 기기를 시작으로 2021년 7월 3등급, 2022년 7월 2등급, 2023년 7월 1등급으로 단계별로 상향한다.
이식 의료기기 출고부터 의료기관에서 실제 사용한 환자까지 추적 가능할 뿐만 아니라, 부작용 등 안전성 정보까지 확인할 수 있는 시스템은 11월에 구축한다.
국민 알권리를 충족하고 정보의 투명한 공개를 강화하기 위해 의약품 전성분 표시제를 7월부터 본격 시행하는 한편, '제네릭 의약품 묶음 정보'를 국민도 쉽게 알 수 있도록 8월부터 의약품 안전나라 홈페이지 등을 통해 단계적으로 공개한다.
제네릭 의약품 묶음 정보는 동일 제조소에서 제조하고 생물학적동등성 시험자료를 공유한 의약품을 뜻한다.
한편 말기암 또는 치료수단이 없는 중증환자가 해외에서만 개발 중인 의약품을 치료에 사용할 수 있도록 절차를 운영함으로써, 희귀‧난치질환자의 치료기회가 확대된다.
한국희귀‧필수의약품센터를 통해 해외 임상시험용의약품 사용신청 및 수입 의약품의 안전성 및 유효성을 현재의 과학수준에서 재평가하는 대상을 보다 명확히 하기 위한 선정기준을 9월에 마련한다.
그 밖에 종이허가증 대신 '의약품등 전자허가증'을 12월에 도입해 비용 절감은 물론 열람 편의성을 개선하고, 12월부터 마약류 투약사범의 재범률을 낮추고 사회복귀 비율을 높이기 위해 200시간 범위 내 재활교육 이수를 의무화 한다.
2020년 하반기 식·의약품 주요 안전정책 추진 일정
26일 식품의약품안전처는 식품‧의약품 등의 안전관리와 관련해 '올해 하반기 달라지는 식품·의약품 주요 정책'을 공개했다.
먼저 유전자치료제 등 첨단바이오의약품에 대한 안전관리를 강화하고 신속한 제품화를 지원하는 '첨단재생바이오법'이 8월 28일 시행됨에 따라 인체세포등 관리업을 신설하고 투약환자에 대한 장기추적조사를 의무화하는 등 맞춤형 관리체계를 시행한다.
바이오의약품은 살아있는 세포·조직 또는 유전자를 원료로 제조한 것으로 세포치료제, 유전자치료제, 조직공학제제 등이 이에 포함된다.
또 의료기기 분야도 지난 5월 1일 '의료기기산업육성 및 혁신의료기기지원법' 시행에 따라 혁신의료기기 지정 및 인허가 특례 등 새로운 제도 운영이 본격화 되고 국민에게 새로운 치료기회를 빠르게 적용할 수 있을 것으로 기대된다.
의료기기 허가부터 유통·사용까지 전주기 안전관리를 위해 의료기관 등에 의료기기를 공급하는 제조·수입·판매·임대업자에 대해 의료기기 공급내역을 보고하는 방안도 추진된다.
시행 시기는 7월. 4등급 기기를 시작으로 2021년 7월 3등급, 2022년 7월 2등급, 2023년 7월 1등급으로 단계별로 상향한다.
이식 의료기기 출고부터 의료기관에서 실제 사용한 환자까지 추적 가능할 뿐만 아니라, 부작용 등 안전성 정보까지 확인할 수 있는 시스템은 11월에 구축한다.
국민 알권리를 충족하고 정보의 투명한 공개를 강화하기 위해 의약품 전성분 표시제를 7월부터 본격 시행하는 한편, '제네릭 의약품 묶음 정보'를 국민도 쉽게 알 수 있도록 8월부터 의약품 안전나라 홈페이지 등을 통해 단계적으로 공개한다.
제네릭 의약품 묶음 정보는 동일 제조소에서 제조하고 생물학적동등성 시험자료를 공유한 의약품을 뜻한다.
한편 말기암 또는 치료수단이 없는 중증환자가 해외에서만 개발 중인 의약품을 치료에 사용할 수 있도록 절차를 운영함으로써, 희귀‧난치질환자의 치료기회가 확대된다.
한국희귀‧필수의약품센터를 통해 해외 임상시험용의약품 사용신청 및 수입 의약품의 안전성 및 유효성을 현재의 과학수준에서 재평가하는 대상을 보다 명확히 하기 위한 선정기준을 9월에 마련한다.
그 밖에 종이허가증 대신 '의약품등 전자허가증'을 12월에 도입해 비용 절감은 물론 열람 편의성을 개선하고, 12월부터 마약류 투약사범의 재범률을 낮추고 사회복귀 비율을 높이기 위해 200시간 범위 내 재활교육 이수를 의무화 한다.
관련기사
- "내부고발 효과있네" 불법 병·의원 신고 포상액 늘린다 2020-06-25 11:50:11
- 울산대병원, 8회 연속 뇌졸중 적정성 평가 '1등급' 2020-06-25 10:54:52
- 꿈꾸던 교수 발령 후 월급 줄어든 외상외과 의사의 사연 2020-06-25 05:45:56
- "변화 뒤쳐지는 급여기준 다학제 근거로 바로잡겠다" 2020-06-25 05:45:00






