- 정책
- 제도・법률
복지부, 체외진단검사 등 신의료기술 평가대상 축소
기존 검사·시술 평가 제외…"시장진입 최대 12개월 빨라져"

이창진 기자
기사입력: 2014-05-02 09:28:35
-
가
기존 검사와 시술의 신의료기술평가 시장 진입이 빨라진다.

보건복지부는 1일 신의료기술평가 대상을 축소하고 신청인에게 의견 개진 기회를 부여한 '신의료기술평가 위원회 운영규정'을 발령 시행한다고 밝혔다.
현재 신의료기술평가 대상인 경우 최소 90일에서 최대 12개월간 안전성 및 유효성 평가를 거쳐 요양급여 결정을 신청해왔다.
이번 운영규정을 적용하면, 체외진단검사는 55%(209건 중 115건), 시술은 약 12%(110건 중 13건) 등이 평가대상에서 제외된다.
체외진단검사는 기존 검사와 유사하거나 개별 검사를 동시 실시하는 검사법으로 신의료기술평가 대상에서 제외한다.
일례로 폐렴 여러 원인균을 동시 검사하는 경우, 기존에는 안전성과 유효성이 확인되더라도 여러 검사를 동시에 시행할 필요가 있는 별도 평가했으나, 평가대상을 축소해 8~9개월 일찍 사용할 수 있게 된 셈이다.
의사들이 행하는 시술도 기존 시술에 일부 시술방법이 추가되거나 단순 자동화된 경우 등 국민건강에 우려가 없는 의료기술은 평가대사에서 제외한다.
이미 시술하고 있는 전립선 비대 치료술에 레이저 종류가 KTP레이저에서 홀뮴레이저로 변경된 경우 별도 평가 없이 사용이 가능하다.
더불어 신의료기술평가 진행 중 신청인 의견을 개진할 수 있는 의료인이 직접 설명하는 절차도 신설했다.
그동안 신청인은 서면으로 의견 및 관련 자료를 제출한 후 평가에 참여할 수 없었으나, 앞으로는 소위원회 심의과정에서 이견을 개진할 수 있다.
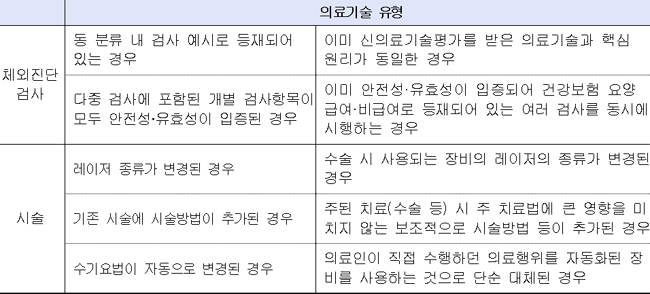
신의료기술평가 대상에서 제외되는 의료기술 유형.
또한 의학적으로 의료기술 안전성 및 효과성을 평가하는 절차는 신청인 측 의견을 대면할 수 있는 의료인이 참여하도록 하고, 지속 모니터링을 통해 평가 공정성 훼손 우려를 차단할 예정이다.
의료자원정책과 관계자는 "이번 제도개선을 통해 신의료기술평가가 면제되는 의료기술을 사용하는 의료기기의 시장진입 시기가 최대 12개월 빨라지고, 신청인의 예측가능성도 높아질 것"이라고 말했다.
한편, 복지부는 품목허가와 신의료기술평가 원스톱 서비스, 품목허가시 임상시험 실시 의료기기 조기 시장진입 등 다른 규제개선 과제를 속도감 있게 추진한다는 방침이다.

현재 신의료기술평가 대상인 경우 최소 90일에서 최대 12개월간 안전성 및 유효성 평가를 거쳐 요양급여 결정을 신청해왔다.
이번 운영규정을 적용하면, 체외진단검사는 55%(209건 중 115건), 시술은 약 12%(110건 중 13건) 등이 평가대상에서 제외된다.
체외진단검사는 기존 검사와 유사하거나 개별 검사를 동시 실시하는 검사법으로 신의료기술평가 대상에서 제외한다.
일례로 폐렴 여러 원인균을 동시 검사하는 경우, 기존에는 안전성과 유효성이 확인되더라도 여러 검사를 동시에 시행할 필요가 있는 별도 평가했으나, 평가대상을 축소해 8~9개월 일찍 사용할 수 있게 된 셈이다.
의사들이 행하는 시술도 기존 시술에 일부 시술방법이 추가되거나 단순 자동화된 경우 등 국민건강에 우려가 없는 의료기술은 평가대사에서 제외한다.
이미 시술하고 있는 전립선 비대 치료술에 레이저 종류가 KTP레이저에서 홀뮴레이저로 변경된 경우 별도 평가 없이 사용이 가능하다.
더불어 신의료기술평가 진행 중 신청인 의견을 개진할 수 있는 의료인이 직접 설명하는 절차도 신설했다.
그동안 신청인은 서면으로 의견 및 관련 자료를 제출한 후 평가에 참여할 수 없었으나, 앞으로는 소위원회 심의과정에서 이견을 개진할 수 있다.

의료자원정책과 관계자는 "이번 제도개선을 통해 신의료기술평가가 면제되는 의료기술을 사용하는 의료기기의 시장진입 시기가 최대 12개월 빨라지고, 신청인의 예측가능성도 높아질 것"이라고 말했다.
한편, 복지부는 품목허가와 신의료기술평가 원스톱 서비스, 품목허가시 임상시험 실시 의료기기 조기 시장진입 등 다른 규제개선 과제를 속도감 있게 추진한다는 방침이다.

정책 기사
- '트라우마 센터' 법안 급물살…외상센터와 닮은 꼴 2014-05-02 11:07:25
- 다른 의사 이름 '키워드 광고' 면허정지 2개월 2014-05-02 06:07:31
- 건보공단, 장기요양 부당청구 신고인에 총 1억여원 포상 2014-05-01 19:01:06
- 의료장비 없는 의원, 환자 의뢰 신경써야 '삭감' 피한다 2014-05-01 17:18:17
- 공정위, 노환규·방상혁 고발…"의협 과징금 5억 부과" 2014-05-01 12:00:00









