- 정책
- 제도・법률
임상시험 부작용 심각 "최근 3년간 49명 사망"
김성주 의원, 임상시험심사위원회(IRB) 국가 주도 검토 주장

문성호 기자
기사입력: 2014-10-07 11:01:13
-
가
연간 수백건에 달하는 의약품 임상시험이 보건당국으로부터 승인받는 가운데, 매년 100건이 넘는 부작용이 보고되고 있는 것으로 나타났다.

국회 보건복지위원회 김성주 의원(새정치민주연합)이 7일 식품의약품안전처로부터 받은 '최근 3년간 의약품 임상시험 승인 현황'에 따르면 ▲2011년 503건 ▲2012년 670건 ▲2013년 607건으로 매년 수백 건의 임상시험 승인이 이뤄지고 있다.
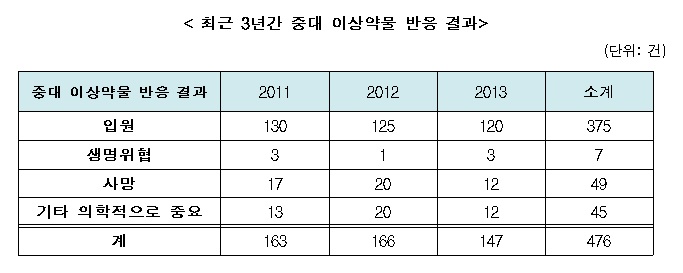
김 의원에 따르면 피험자들의 부작용인 '중대 이상약물 반응보고'의 경우 최근 3년간 476건이나 발생했으며 해마다 평균 160여건의 부작용이 발생하는 것으로 집계됐다.
중대 이상약물 반응보고란 의약품 임상시험 의뢰자인 제약사 등이 임상시험 중 발생된 중대하고 예상하지 못한 이상약물반응을 관련 법령(의약품 임상시험 관리기준)에 따라 보고하는 것을 의미하는 것으로, 일종의 부작용 보고다.
김 의원은 이러한 중대 이상약물 반응이 단순한 부작용으로 말하기에는 그 정도와 피해가 심각하다고 지적했다.
최근 3년간 중대 이상약물 반응 결과에 따르면 총 476건 중 375건의 입원이 있었고 ▲7건의 생명위협 ▲49건의 사망 ▲45건의 기타 의학적으로 중요한(심각한) 반응이 있었다.
김 의원은 "현재 식약처는 임상시험 의뢰자가 임상시험과 관련해 발생한 환자 피해에 대한 보상기준을 마련토록 의무화하고 있지만, 실제 정당한 보상이 이뤄지는 지에 대해서도 식약처가 관리를 해야 한다"고 지적했다.
이어 "현재 임상시험기관 내에 설치하는 임상시험심사위원회(IRB)를 미국, 일본, 영국의 경우와 같이 국가 주도나 외부 비영리법인을 통해 심사의 객관성과 공정성, 투명성을 더할 방안을 고려할 필요가 있다"고 주장했다.

김 의원에 따르면 피험자들의 부작용인 '중대 이상약물 반응보고'의 경우 최근 3년간 476건이나 발생했으며 해마다 평균 160여건의 부작용이 발생하는 것으로 집계됐다.
중대 이상약물 반응보고란 의약품 임상시험 의뢰자인 제약사 등이 임상시험 중 발생된 중대하고 예상하지 못한 이상약물반응을 관련 법령(의약품 임상시험 관리기준)에 따라 보고하는 것을 의미하는 것으로, 일종의 부작용 보고다.

최근 3년간 중대 이상약물 반응 결과에 따르면 총 476건 중 375건의 입원이 있었고 ▲7건의 생명위협 ▲49건의 사망 ▲45건의 기타 의학적으로 중요한(심각한) 반응이 있었다.
김 의원은 "현재 식약처는 임상시험 의뢰자가 임상시험과 관련해 발생한 환자 피해에 대한 보상기준을 마련토록 의무화하고 있지만, 실제 정당한 보상이 이뤄지는 지에 대해서도 식약처가 관리를 해야 한다"고 지적했다.
이어 "현재 임상시험기관 내에 설치하는 임상시험심사위원회(IRB)를 미국, 일본, 영국의 경우와 같이 국가 주도나 외부 비영리법인을 통해 심사의 객관성과 공정성, 투명성을 더할 방안을 고려할 필요가 있다"고 주장했다.

정책 기사
- 시급성 이유로 세포치료제 허가 "알고보니 생산전무" 2014-10-07 10:45:24
- 남윤인순 의원 "의약품 23개 품목, 품질 부적합 회수" 2014-10-07 10:08:06
- 문정림 의원 "운동보조제에 금지성분 38건 포함" 2014-10-07 09:58:21
- 유럽서 금지한 아기용파우더 성분, 국내 사용 여전 2014-10-07 09:54:18
- 어린이용치약 '파라벤' 기준치, 구강티슈의 20배 2014-10-07 09:40:12









