- 의료기기·AI
- 진단
고위험도 의료기기 92개 품목 ‘재평가’
7월 20일부터 9월 19일까지 업체 재평가 신청접수

정희석 기자
기사입력: 2015-03-19 14:56:37
-
가
이미 허가 받은 고위험도 의료기기 92개 품목·476개 제품에 대한 안전성·유효성 재평가가 이뤄진다.
식약처는 시중에 판매 중인 의료기기 중 상대적으로 위해성이 높은 의료기기 92개 품목·476개 제품을 대상으로 안전성·유효성 재평가를 할 계획이라고 19일 밝혔다.
이를 위해 해당 품목을 보유한 의료기기업체는 오는 7월 20일부터 9월 19일까지 재평가 신청을 해야 한다.
의료기기 재평가는 2009년 도입됐으며, 이미 허가 받아 판매하는 제품을 대상으로 최신의 과학 수준에서 안전성·유효성을 다시 검증하는 사후관리제도.
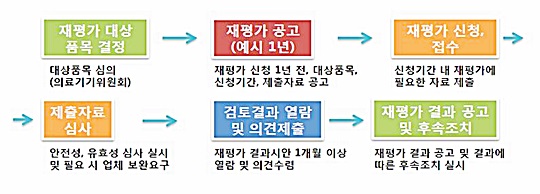
의료기기위원회 심의를 거쳐 재평가 대상품목을 선정하고, 업체로부터 관련된 품목에 대한 안전성 정보 자료 등을 제출 받아 재평가를 실시하게 된다.
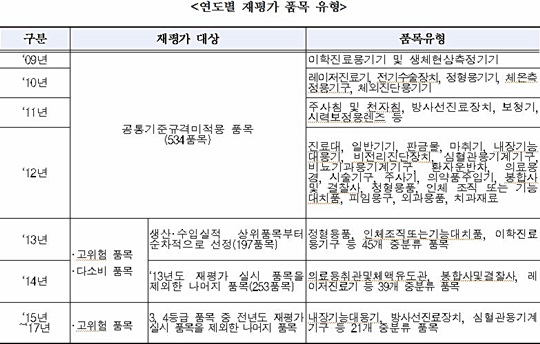
그동안 재평가 대상은 ▲공통기준규격미적용 품목(2009년~2012년) ▲고위험다소비 품목(2013년~2014년) ▲고위험 품목(전년도 미실시 품목·2015년~2017년)으로 이뤄졌다.
앞서 2009년부터 2012년까지는 2000년 이전에 허가된 제품들이 생물학적 안전성 등 공통기준규격에 적합한지 재평가를 실시했다.
이어 2013년과 2014년에는 정형용품 등 위해성이 높고 다소비 품목을 중심으로 안전성과 유효성을 재평가한 바 있다.
현재 허가 받아 판매 중인 의료기기는 총 2206개 품목·7만5748개 제품이며, 지난해까지 984개 품목·1만3223개 제품이 재평가를 받았다.
이중 5721개 제품은 안전성과 유효성에 적합했고, 3453개 제품은 시장성이 없는 등의 이유로 업체 자발적으로 품목 취하했으며, 178개 제품은 업체 폐업 등으로 품목이 취소됐다.
또 3542개 제품은 최종 재평가 진행 중에 있으며, 329개 제품은 제출자료 미비, 재평가 미신청 등으로 행정처분을 받았다.
식약처는 “내실 있는 의료기기 재평가 제도를 운영해 최신의 과학기술을 바탕으로 안전성 및 유효성이 검증된 의료기기가 유통될 수 있도록 하겠다”며 “재평가 대상업체는 재평가 신청 기간 중에 꼭 신청할 것”을 당부했다.
2015년도 재평가 실시 계획은 식약처 홈페이지(www.mfds.go.kr)→알림→공고 란에서 확인 가능하다.
식약처는 시중에 판매 중인 의료기기 중 상대적으로 위해성이 높은 의료기기 92개 품목·476개 제품을 대상으로 안전성·유효성 재평가를 할 계획이라고 19일 밝혔다.
이를 위해 해당 품목을 보유한 의료기기업체는 오는 7월 20일부터 9월 19일까지 재평가 신청을 해야 한다.
의료기기 재평가는 2009년 도입됐으며, 이미 허가 받아 판매하는 제품을 대상으로 최신의 과학 수준에서 안전성·유효성을 다시 검증하는 사후관리제도.
그동안 재평가 대상은 ▲공통기준규격미적용 품목(2009년~2012년) ▲고위험다소비 품목(2013년~2014년) ▲고위험 품목(전년도 미실시 품목·2015년~2017년)으로 이뤄졌다.
앞서 2009년부터 2012년까지는 2000년 이전에 허가된 제품들이 생물학적 안전성 등 공통기준규격에 적합한지 재평가를 실시했다.
이어 2013년과 2014년에는 정형용품 등 위해성이 높고 다소비 품목을 중심으로 안전성과 유효성을 재평가한 바 있다.
이중 5721개 제품은 안전성과 유효성에 적합했고, 3453개 제품은 시장성이 없는 등의 이유로 업체 자발적으로 품목 취하했으며, 178개 제품은 업체 폐업 등으로 품목이 취소됐다.
또 3542개 제품은 최종 재평가 진행 중에 있으며, 329개 제품은 제출자료 미비, 재평가 미신청 등으로 행정처분을 받았다.
식약처는 “내실 있는 의료기기 재평가 제도를 운영해 최신의 과학기술을 바탕으로 안전성 및 유효성이 검증된 의료기기가 유통될 수 있도록 하겠다”며 “재평가 대상업체는 재평가 신청 기간 중에 꼭 신청할 것”을 당부했다.
2015년도 재평가 실시 계획은 식약처 홈페이지(www.mfds.go.kr)→알림→공고 란에서 확인 가능하다.

의료기기·AI 기사
- 한국지멘스 ‘지멘스그린스쿨’ 진행 2015-03-18 10:08:11
- 의료기기 불법 유통 집중 단속 2015-03-18 09:46:17
- 로슈진단 혈액분석장비, 드라마 현실감 “살아있네” 2015-03-17 16:56:18
- 약제비 계산, 모바일로 “스마트하게” 2015-03-17 16:46:48
- 녹십자엠에스, 모바일 체외진단시장 ‘노크’ 2015-03-17 16:36:23









