- 의료기기·AI
- 진단
인체이식 의료기기 ‘실리콘겔인공유방’ 안전관리 강화
식약처, 5개 업체 8개 제품 재평가…사용시 주의사항 등 추가

정희석 기자
기사입력: 2017-06-28 18:32:37
-
가
식약처가 ‘실리콘겔인공유방’ 5개 업체 8개 제품을 재평가해 사용방법과 사용 시 주의사항 등을 추가하는 재평가 결과를 공고했다.
재평가는 유방암 치료나 미용 등에 사용되는 실리콘겔인공유방이 수술 이후 파열 및 구형구축 등 부작용이 지속적으로 발생함에 따라 2015년 10월 재평가를 공고하고 진행됐다.
참고로 실리콘겔인공유방 부작용 건수는 2013년 1176건, 2014년 940건, 2015년 985건, 2016년 657건에 달한다.
28일 식약처에 따르면, 재평가 대상은 2015년 10월 재평가 결정 당시 허가돼 있던 8개 제품이었으며 2017년 6월 현재 허가된 실리콘겔인공유방은 8개 업체 12개 제품들로 이번 재평가 대상에서 제외된 4개 제품도 재평가 결과를 허가사항에 반영할 예정이다.
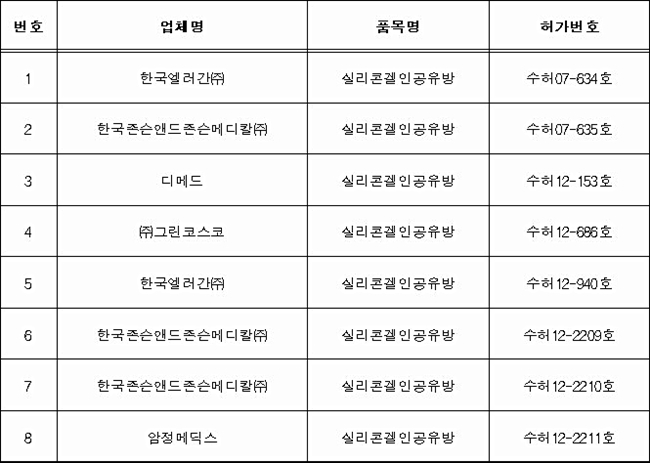
실리콘겔인공유방 재평가 대상 제품 현황
재평가 과정은 해당업체로부터 제출받은 부작용 등 이상사례, 안전성 자료, 임상자료, 논문 등 안전성·유효성 자료를 토대로 검토를 진행했다.
이어 의료계·학계 전문가·소비자단체 등으로 구성된 의료기기심의위원회 자문을 거쳤다.
이번 재평가로 실리콘겔인공유방 사용 시 주의사항 등 허가사항이 추가돼 안전관리가 강화된다.
우선 사용 시 주의사항에는 실리콘겔인공유방 수술 후 3년이 되면 MRI 검사로 파열여부를 확인하고 그 이후에는 2년 주기로 파열 여부 검사를 받을 것을 권고하는 내용이 담겨 있다.
더불어 실리콘겔인공유방 이식 여성은 모유 수유 전 보형물 파열 여부를 전문의에게 진단 받도록 했다.
또 의료인은 실리콘켈인공유방을 사용해 수술하기 전 제품 표면에 이물질이 묻어 있는지 확인하고 환자에게 거친 표면 제품이 매끄러운 표면 제품보다 이식 후 역형성대세포림프종(BIA-ALCL)이 더 빈번하게 발생할 수 있다는 내용을 알리도록 했다.
아울러 가이드라인으로 운영하던 중금속 기준을 시험규격으로 설정해 중금속 기준을 더욱 명확하게 했다.
식약처는 “앞으로도 국민들이 의료기기를 믿고 사용할 수 있도록 의료기기 재평가 등 의료기기 안전관리에 최선을 다하겠다”고 밝혔다.
재평가는 유방암 치료나 미용 등에 사용되는 실리콘겔인공유방이 수술 이후 파열 및 구형구축 등 부작용이 지속적으로 발생함에 따라 2015년 10월 재평가를 공고하고 진행됐다.
참고로 실리콘겔인공유방 부작용 건수는 2013년 1176건, 2014년 940건, 2015년 985건, 2016년 657건에 달한다.
28일 식약처에 따르면, 재평가 대상은 2015년 10월 재평가 결정 당시 허가돼 있던 8개 제품이었으며 2017년 6월 현재 허가된 실리콘겔인공유방은 8개 업체 12개 제품들로 이번 재평가 대상에서 제외된 4개 제품도 재평가 결과를 허가사항에 반영할 예정이다.
이어 의료계·학계 전문가·소비자단체 등으로 구성된 의료기기심의위원회 자문을 거쳤다.
이번 재평가로 실리콘겔인공유방 사용 시 주의사항 등 허가사항이 추가돼 안전관리가 강화된다.
우선 사용 시 주의사항에는 실리콘겔인공유방 수술 후 3년이 되면 MRI 검사로 파열여부를 확인하고 그 이후에는 2년 주기로 파열 여부 검사를 받을 것을 권고하는 내용이 담겨 있다.
더불어 실리콘겔인공유방 이식 여성은 모유 수유 전 보형물 파열 여부를 전문의에게 진단 받도록 했다.
또 의료인은 실리콘켈인공유방을 사용해 수술하기 전 제품 표면에 이물질이 묻어 있는지 확인하고 환자에게 거친 표면 제품이 매끄러운 표면 제품보다 이식 후 역형성대세포림프종(BIA-ALCL)이 더 빈번하게 발생할 수 있다는 내용을 알리도록 했다.
아울러 가이드라인으로 운영하던 중금속 기준을 시험규격으로 설정해 중금속 기준을 더욱 명확하게 했다.
식약처는 “앞으로도 국민들이 의료기기를 믿고 사용할 수 있도록 의료기기 재평가 등 의료기기 안전관리에 최선을 다하겠다”고 밝혔다.

의료기기·AI 기사
- 옴니씨앤에스, 건강관리 플랫폼 ‘옴니핏’ 체험 행사 2017-06-28 17:35:43
- 알로텍, KOTRA ‘수출혁신기업상’ 수상 2017-06-28 17:21:57
- 엘러간, 의료기기사 ‘켈러 메디컬’ 인수 추진 2017-06-26 11:27:00
- 현실로 다가온 ‘인공지능·가상현실’ 의료 경쟁 서막 2017-06-26 01:06:39
- 티플러스, 헬스케어 클라우드 서비스 포문 2017-06-26 01:02:23









