- 의료기기·AI
- 진단
7 테슬라 MR ‘마그네톰 테라’ 임상용 승인 획득
뇌신경·근골격계 검사 정밀한 MR 영상 제공

정희석 기자
기사입력: 2017-09-07 10:35:15
-
가
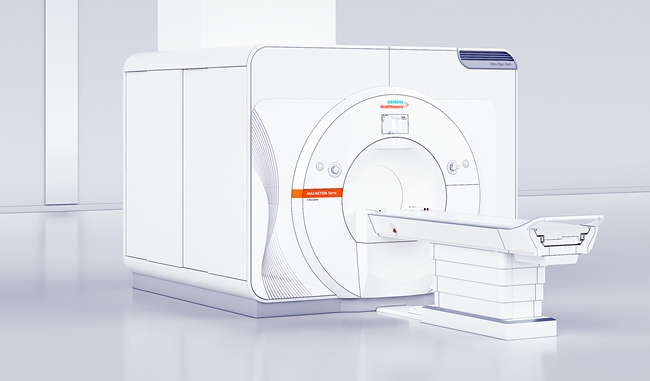
마그네톰 테라 CE 인증 획득은 이 장비가 영상의학 분야에서 안정성·임상적 유익성 및 환경 보호 측면에서 모든 EU 요구사항에 충족한다는 것을 의미한다.
앞으로 유럽 의료진들은 일상적인 임상 현장에서 신경 및 근골격계 검사에 마음 놓고 이 시스템을 활용할 수 있게 됐다.
지멘스 헬시니어스 MRI 담당 수석 부사장 겸 본부장인 크리스토프 진델(Christoph Zindel) 박사는 “오랜 세월 초고자장 MRI 분야에서 전 세계 연구 협력 파트너들의 광범위한 네트워크를 하나로 연결해 연구에 매진한 결과 임상 현장에서 7 테슬라 MR 영상을 마그네톰 테라 장비로 실현할 수 있게 됐다”고 설명했다.
그는 “마그네톰 테라 CE 인증 획득은 3 테슬라 MR 장비가 처음 개발된 이후 15년 만에 이룬 쾌거라 할 수 있다”며 “새로운 임상용 자장 세기를 토대로 인체 내부 조직 및 기능 검사에서 새로운 차원의 정밀도를 실현함으로써 정밀 의료 발전에 박차를 가할 수 있게 됐다”고 평가했다.
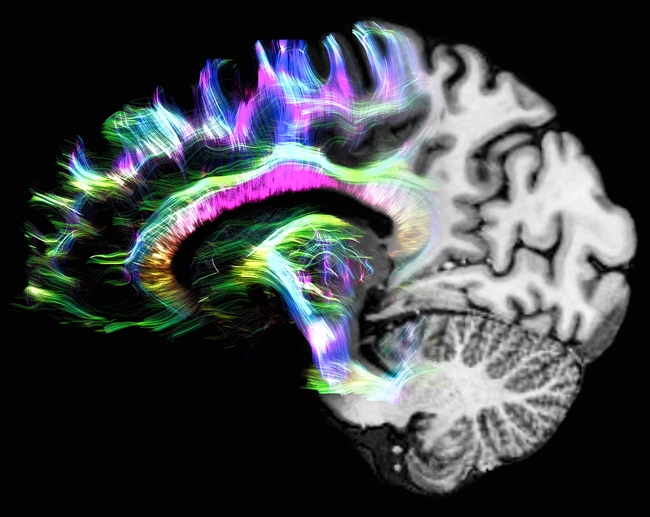
특히 뇌 촬영 시 해상도가 뛰어나고 영상 대비가 선명하기 때문에 병변을 훨씬 명확하게 식별할 수 있다.
따라서 뇌전증 환자를 검사할 때 백질과 회백질이 선명하게 구분되기 때문에 자장 세기가 낮을 때 불가능했던 정밀한 진단이 가능하다.
또한 뇌 회백질에서 인지 장애를 야기하는 병변을 정확하게 식별할 수 있어 다발성 경화증 환자를 진단할 때도 유리하며 신호 대 잡음비(SNR)와 조직 대조도가 높고 공간 해상도가 뛰어나 3 테슬라 MR 장비에서 확인할 수 없었던 영상 정보까지 확보할 수 있다.
현재 마그네톰 테라의 FDA 승인 상태는 “510(k) 보류 중”이며 국내 수입품목허가는 받기 전 단계에 있다.

의료기기·AI 기사
- 셀바스 AI, 대구파티마병원에 ‘셀비 메디보이스’ 공급 2017-09-07 00:19:47
- “K-HOSPITAL FAIR는 보고 듣고 토론하는 장” 2017-09-07 00:00:00
- 다가올 ‘초고령사회’ 헬스케어디자인 방향 모색 2017-09-04 18:01:01
- 라이프시맨틱스, 119생명번호 보급 캠페인 2017-09-04 16:35:37
- BIS 기반 만성 콩팥병 수분 관리 중요성 재확인 2017-09-04 16:26:08









