- 제약·바이오
- 국내사
기허가 복합제 579품목, 2012년 생동성 재평가
"2012년도 생동성재평가 780품목, 문헌재평가 1147품목"

이석준 기자
기사입력: 2010-01-02 06:45:00
-
가

특히 생동성 재평가 의약품 가운데 약 4분의 3이 복합제인 것으로 나타나 관련 업계의 부담은 크게 가중될 전망이다.
식약청은 최근 이같은 내용을 포함한 <2012년도 의약품 재평가 대상품목>을 예시했다.
▲ "기허가 복합제 579품목, 2012년 생동성 재평가"
2012년도 생동성 재평가 대상에는 복합제 의약품이 대거 포함됐다. 이는 인체 내 약효 동등성 시험을 거치지 않은 복합제 제네릭이 시중에 유통, 효능 및 안전성 등이 확보되지 않았다는 지적에 따른 것이다. 그간 복합제는 생동성 시험이 의무화되는 단일제와는 달리 간단한 비교용출시험만으로도 품목 허가가 가능했다.
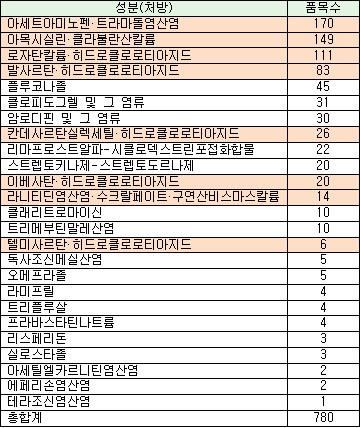
대상은 '아세트아미노펜·트라마돌염산염'(170품목), '아목시실린·클라불란산칼륨'(149품목), '로자탄칼륨·히드로클로로티아지드'(111품목), '발사르탄·히드로클로로티아지드'(83품목), '칸데사르탄실렉세힐·히드로클로로티아지드'(26품목), '이베사탄·히드로클로로티아지드'(20품목), '라니티딘염산염.수크랄페이트·구연산비스마스칼륨'(14품목), '텔미사르탄·히드로클로로티아지드'(8품목) 등 총 8개 성분, 579품목이다. 이는 전체 재평가 의약품(780품목)의 약 4분의 3(74.23%)에 해당되는 수치다.
이에따라 기허가 복합제를 보유한 업체들의 부담은 한층 가중될 것으로 보인다.
국내 상위 D사 관계자는 "단일제 생동성 입증도 힘든 시점에서 (그간 실시되지 않았던) 복합제 생동으로 업계의 부담이 더욱 가중될 것"이라며 한숨을 내쉬었다.
국내 중소 H사 관계자 역시 "청에서 하라고 하면 해야겠지만, 우리같이 규모가 작은 기업에게는 많은 부담이 작용할 것"이라며 "(복합제) 품목당 생동비용은 1억5000원 선이 될 것"이라고 말했다.
2012년 문허재평가 의약품은 자궁수축제 등 29개 약효군의 94개 성분, 1147품목으로 정해졌다.
이중 ‘글리메피리드’(121품목), ‘피오글리타존염산염’(97품목), ‘피나스테리드’(90품목), ‘리세드론산나트륨’(73품목), ‘엘-주석산톨터로딘’(67품목), ‘알렌드론산나트륨’(62품목) 등 6개 성분이 50품목 이상으로 많았다.
한편, 이르면 올 하반기부터 복합제 품목 허가시 생동성시험이 의무화된다.
식약청은 오는 22일까지 의견수렴 기간을 거치고 고시 이후 6개월의 유예기간을 부여할 방침이다.

제약·바이오 기사
- 식약청 "지난주 원료의약품 126품목 대거 허가" 2009-12-31 11:51:12
- '쎄레브렉스' 복제약 4품목 생동성 계획서 승인 2009-12-31 11:27:10
- 화이자 '프리베나13' 미국 승인 결정 다시 연기 2009-12-31 09:24:04
- FDA, 임신중 복용 약물에 대한 안전성 평가 실시 2009-12-31 09:18:46
- 난소암 발생 수년전, 3종 단백질 상승 나타나 2009-12-31 09:15:52









