- 제약·바이오
- 국내사
내달 의약품 품목 갱신제 시행…하반기 새 정책은?
발행날짜: 2017-06-29 12:00:40
-
가
-
식약처, 일반약 표시정보 개선·전성분 표시제 등 시행
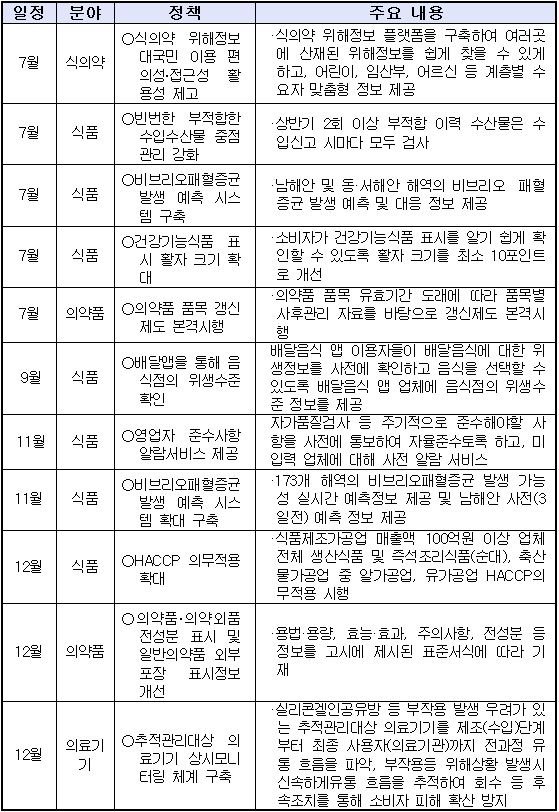
7월부터 의약품 품목 갱신제도 본격 시행된다. 또 하반기에는 일반의약품 외부포장 정보 표시가 개선되고 위해도가 높은 추적관리대상 의료기기에 대한 상시 모니터링 체계 구축 등이 시행된다.
29일 식품의약품안전처는 이같은 내용의 올해 하반기 식·의약품 주요 정책을 소개했다.
의료 분야는 ▲의약품 품목 갱신제도 본격 시행(7월) ▲일반의약품 외부포장 표시정보 읽기 쉽게 개선(12월) ▲위해도가 높은 추적관리대상 의료기기에 대한 상시 모니터링 체계 구축(12월) 등이 시행된다.
기존에 허가·신고 되었던 품목이라도 제품의 안전성과 유효성 등을 주기적으로 재검토해 허가 유지 여부를 결정하는 의약품 품목 갱신제도가 7월부터 본격 시행된다.
품목별로 허가‧신고 유효기간 종료 6개월 전에 갱신을 신청해야 하며, 위해우려가 있거나 기간 내 신청하지 않은 품목 등은 판매할 수 없게 된다.
또 의약품 안전사용 정보제공 확대를 위해 12월부터는 의약품에 함유된 유효성분, 첨가제 등 모든 성분을 용기‧포장에 기재해야 한다.
특히 일반의약품은 외부 용기‧포장에 '주표시면'과 '정보표시면'으로 구분 기재하고 '정보표시면'에는 표준 서식에 따라 소비자가 읽기 쉽게 표시해야 한다.
식약처는 용법·용량, 효능·효과, 주의사항, 전성분 등 의약품 사용에 필요한 주요 정보를 기재할 때의 표 형식, 글자크기 등을 제시한 표준도안을 마련했다.
의약외품에도 함유된 모든 성분을 용기‧포장에 표시해야 하며, '유효성분'과 첨가제 중 '보존제', '타르색소', '기타 첨가제'로 구분 기재해야 한다.
위해성 등이 있는 의료기기를 사용한 환자에 대한 추적관리가 오는 12월부터 가능해져 부작용 발생 시 환자에게 신속하게 알리고 피해가 확산되는 것을 방지한다.
추적관리 의료기기는 '이식형 인공심장박동기' 등 인체에 1년 이상 삽입(48개 품목), '개인용 인공호흡기' 등 의료기관 외에서 사용가능한 생명유지용 의료기기(4개품목)이다.
식의약 위해정보 접근성 강화를 위한 전용사이트도 7월부터 서비스를 제공한다. 식약처는 어린이‧임산부 등 대상별 맞춤형 대국민 서비스 항목을 신설하고 이용자가 정보를 쉽게 찾을 수 있도록 검색 기능을 강화해 식의약 위해정보 이용의 편의성을 강화한다는 방침이다.
2017년 하반기 식·의약품 주요 안전정책 추진 일정
29일 식품의약품안전처는 이같은 내용의 올해 하반기 식·의약품 주요 정책을 소개했다.
의료 분야는 ▲의약품 품목 갱신제도 본격 시행(7월) ▲일반의약품 외부포장 표시정보 읽기 쉽게 개선(12월) ▲위해도가 높은 추적관리대상 의료기기에 대한 상시 모니터링 체계 구축(12월) 등이 시행된다.
기존에 허가·신고 되었던 품목이라도 제품의 안전성과 유효성 등을 주기적으로 재검토해 허가 유지 여부를 결정하는 의약품 품목 갱신제도가 7월부터 본격 시행된다.
품목별로 허가‧신고 유효기간 종료 6개월 전에 갱신을 신청해야 하며, 위해우려가 있거나 기간 내 신청하지 않은 품목 등은 판매할 수 없게 된다.
또 의약품 안전사용 정보제공 확대를 위해 12월부터는 의약품에 함유된 유효성분, 첨가제 등 모든 성분을 용기‧포장에 기재해야 한다.
특히 일반의약품은 외부 용기‧포장에 '주표시면'과 '정보표시면'으로 구분 기재하고 '정보표시면'에는 표준 서식에 따라 소비자가 읽기 쉽게 표시해야 한다.
식약처는 용법·용량, 효능·효과, 주의사항, 전성분 등 의약품 사용에 필요한 주요 정보를 기재할 때의 표 형식, 글자크기 등을 제시한 표준도안을 마련했다.
의약외품에도 함유된 모든 성분을 용기‧포장에 표시해야 하며, '유효성분'과 첨가제 중 '보존제', '타르색소', '기타 첨가제'로 구분 기재해야 한다.
위해성 등이 있는 의료기기를 사용한 환자에 대한 추적관리가 오는 12월부터 가능해져 부작용 발생 시 환자에게 신속하게 알리고 피해가 확산되는 것을 방지한다.
추적관리 의료기기는 '이식형 인공심장박동기' 등 인체에 1년 이상 삽입(48개 품목), '개인용 인공호흡기' 등 의료기관 외에서 사용가능한 생명유지용 의료기기(4개품목)이다.
식의약 위해정보 접근성 강화를 위한 전용사이트도 7월부터 서비스를 제공한다. 식약처는 어린이‧임산부 등 대상별 맞춤형 대국민 서비스 항목을 신설하고 이용자가 정보를 쉽게 찾을 수 있도록 검색 기능을 강화해 식의약 위해정보 이용의 편의성을 강화한다는 방침이다.

관련기사
- 헷갈리는 의약품 전성분 표시제 이것만 알면 OK 2017-06-03 05:30:47
- 깨알 글씨 사라지나? 의약품 표시 가독성 향상 추진 2017-06-20 10:42:31
- "알권리 강화" 식약처, 의약품 전성분표시제 시행 2017-01-09 11:56:04
- 제약업계, 올해부터 달라지는 열 가지 제도는 2017-01-24 12:00:33






