- 제약·바이오
- 국내사
스페인산 발사르탄 원료에도 발암 가능 물질 검출
스페인 퀴미카 신테티카사 원료의약품서 NDMA 검출…"해당 완제의약품 7월부터 판매중지"

최선 기자
기사입력: 2018-08-23 09:24:51
-
가
중국산에 이어 스페인산 발사르탄 원료의약품에서도 N-니트로소디메틸아민(NDMA)이 검출됐다.
23일 식품의약품안전처는 지난 8월 6일 41개 품목에 대한 중간조사 결과 발표 이후 나머지 '발사르탄' 원료의약품 45개 품목을 수거‧검사한 결과, 2개 품목에서 'NDMA' 기준을 초과한 것으로 확인됐다고 밝혔다.
해당 원료의약품들은 스페인 퀴미카 신테티카(Quimica Sintetica)社가 제조해 팜스웰바이오가 수입한 1개 품목과 중국 지앙쑤 종방(Jiangsu Zhongbang)사가 제조한 명문제약의 1개 품목이다.
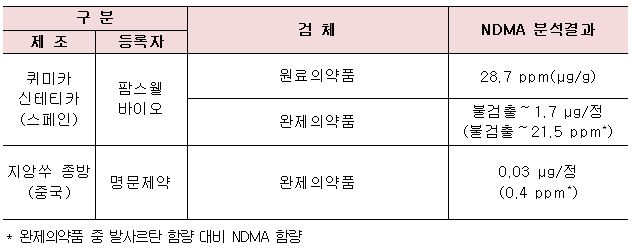
발사르탄 관련 추가 검사 결과
최근 3년(2015~2017) 국내 전체 '발사르탄' 원료의약품 시장에서 팜스웰바이오(스페인 퀴미카 신테티카)는 약 0.04%, 명문제약(중국 지앙쑤 종방)의 비중은 약 0.07%이다.
다만, 이번에 해당 원료의약품을 사용해 추가로 판매중지 및 처방 제한되는 완제의약품은 명문제약의 '발사닌정80밀리그램(발사르탄)' 1개 품목이다.
팜스웰바이오의 '발사르탄'을 사용한 5개 완제의약품은 지난 7월 7일에 이미 판매 중지됐다.
식약처는 현재 해당 '발사르탄' 원료의약품에서 'NDMA'가 기준을 초과한 원인 등에 대해 면밀히 검토를 진행하고 있다.
식약처는 원료의약품 불순물 관리를 강화하기 위해 원료의약품에 대한 전반적인 안전관리 개선 방안을 마련해 시행할 예정이다.
앞으로 원료의약품 등록 제도를 개선해 의약품에 포함될 수 있는 불순물에 대한 자체 관리를 의무화하고, 해외제조소 등록제 및 실사 근거를 법제화해 관리 체계를 강화한다.
또 제약사가 '발사르탄'의 'NDMA' 기준 적합 여부를 확인한 후 적합한 원료만 사용할 수 있도록 해 안전한 제품만 유통될 수 있도록 조치할 계획이다.
지난 8월 6일 발표 이후 '발사르탄'의 'NDMA' 함량 분석 결과, 건강보험심사평가원이 보유한 환자 정보 등을 바탕으로 NDMA 검출 제품을 복용했던 환자들에 대한 영향 평가를 진행하고 있으며, 이후 그 결과를 공개할 예정이다.
23일 식품의약품안전처는 지난 8월 6일 41개 품목에 대한 중간조사 결과 발표 이후 나머지 '발사르탄' 원료의약품 45개 품목을 수거‧검사한 결과, 2개 품목에서 'NDMA' 기준을 초과한 것으로 확인됐다고 밝혔다.
해당 원료의약품들은 스페인 퀴미카 신테티카(Quimica Sintetica)社가 제조해 팜스웰바이오가 수입한 1개 품목과 중국 지앙쑤 종방(Jiangsu Zhongbang)사가 제조한 명문제약의 1개 품목이다.

다만, 이번에 해당 원료의약품을 사용해 추가로 판매중지 및 처방 제한되는 완제의약품은 명문제약의 '발사닌정80밀리그램(발사르탄)' 1개 품목이다.
팜스웰바이오의 '발사르탄'을 사용한 5개 완제의약품은 지난 7월 7일에 이미 판매 중지됐다.
식약처는 현재 해당 '발사르탄' 원료의약품에서 'NDMA'가 기준을 초과한 원인 등에 대해 면밀히 검토를 진행하고 있다.
식약처는 원료의약품 불순물 관리를 강화하기 위해 원료의약품에 대한 전반적인 안전관리 개선 방안을 마련해 시행할 예정이다.
앞으로 원료의약품 등록 제도를 개선해 의약품에 포함될 수 있는 불순물에 대한 자체 관리를 의무화하고, 해외제조소 등록제 및 실사 근거를 법제화해 관리 체계를 강화한다.
또 제약사가 '발사르탄'의 'NDMA' 기준 적합 여부를 확인한 후 적합한 원료만 사용할 수 있도록 해 안전한 제품만 유통될 수 있도록 조치할 계획이다.
지난 8월 6일 발표 이후 '발사르탄'의 'NDMA' 함량 분석 결과, 건강보험심사평가원이 보유한 환자 정보 등을 바탕으로 NDMA 검출 제품을 복용했던 환자들에 대한 영향 평가를 진행하고 있으며, 이후 그 결과를 공개할 예정이다.

제약·바이오 기사
- CSO 리스크 부각…제약사, 자체 감사 등 관리 분주 2018-08-23 06:00:44
- 베링거 '프라닥사' 신규 임상 심장학회 공개 앞둬 2018-08-22 11:31:57
- 영양요법 의존 단장증후군 분야 국내 신약 허가 2018-08-22 11:12:46
- 엄격해진 바이오 연구개발비…성장통vs실적 악화 딜레마 2018-08-22 06:00:49
- 신규 당뇨약 처방 확대? 신장질환 합병증 새 키워드 2018-08-22 06:00:02









