- 병·의원
- 개원가
식약청, 인공유방 환자에 정기 검진 권고
"MRI 통한 보형물 파열 등 부작용 사전 예방 필요"

최선 기자
기사입력: 2011-06-24 16:15:36
-
가
식품의약품안전청이 실리콘겔 인공유방의 부작용 예방을 위해 소비자의 정기검진을 권고했다.
24일 식약청은 "보형물 주변이 딱딱해 지는 현상이나 파열 등의 부작용이 발생할 수 있다"며 주기적인 정기검진 실시와 MRI 촬영 등의 권고 사항을 결정했다.
이번 식약청의 정기검진 권고는 미국 FDA가 실리콘겔 인공유방의 부작용 등 위험성을 발표한데 따른 것이다.
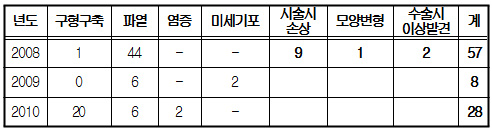
실리콘겔 인공유방 관련 부작용 보고(최근 3년)
보고된 바에 따르면 실리콘겔 인공유방의 부작용·합병증은 보형물 주변이 딱딱해 지는 현상이나 보형물 파열, 주름생성, 비대칭성, 흉터, 통증과 감염 등이다.
국내 실리콘겔 인공유방은 2008년부터 2010년까지 미국 Mentor사와 Allergan에서 제조된 제품이 10만여개 수입됐으며 같은 기간 구형구축, 파열, 염증 등의 부작용 사례는 93건 보고됐다.
식약청은 "인공유방은 영구이식 제품이 아니다"면서 "가슴확대 환자 중 20%는 이식 후 10년 이내에, 가슴재건 환자 중 50%는 이식 후 10년 후에 기존 제품을 제거할 필요가 있다"고 전했다.
이어 식약청은 "인공유방 관련 의료인은 MRI 촬영을 포함한 정기검진과 부작용 관련 사항을 환자에 주지시켜 줄 것"을 당부했다.

24일 식약청은 "보형물 주변이 딱딱해 지는 현상이나 파열 등의 부작용이 발생할 수 있다"며 주기적인 정기검진 실시와 MRI 촬영 등의 권고 사항을 결정했다.
이번 식약청의 정기검진 권고는 미국 FDA가 실리콘겔 인공유방의 부작용 등 위험성을 발표한데 따른 것이다.

국내 실리콘겔 인공유방은 2008년부터 2010년까지 미국 Mentor사와 Allergan에서 제조된 제품이 10만여개 수입됐으며 같은 기간 구형구축, 파열, 염증 등의 부작용 사례는 93건 보고됐다.
식약청은 "인공유방은 영구이식 제품이 아니다"면서 "가슴확대 환자 중 20%는 이식 후 10년 이내에, 가슴재건 환자 중 50%는 이식 후 10년 후에 기존 제품을 제거할 필요가 있다"고 전했다.
이어 식약청은 "인공유방 관련 의료인은 MRI 촬영을 포함한 정기검진과 부작용 관련 사항을 환자에 주지시켜 줄 것"을 당부했다.


병·의원 기사
- "저출산 문제, 베이비 플랜으로 잡겠다" 2011-06-25 06:30:09
- "한국 의료, 이젠 메이요·하버드와 어깨 나란히" 2011-06-24 12:20:58
- "00대 학생 라식시술 특별할인" 2011-06-24 12:16:04
- "한의약 육성법 못 막아 죄송합니다" 2011-06-24 11:06:04
- "나이롱 환자, 전자 청구 방식으로 막아야" 2011-06-24 09:42:10









