- 정책
- 제도・법률
보건연 "신의료기술 한시적 승인제도 도입"
복지부에 건의…식약청 허가와 신의료기술평가도 연계

장종원 기자
기사입력: 2011-02-11 09:46:02
-
가

한국보건의료연구원 신의료기술평가사업본부 이선희 연구위원은 11일 열린 건보공단 조찬세미나에서 "신의료기술 한시적 승인제도를 복지부에 건의했다"고 밝혔다.
이 연구위원은 현재의 신의료기술평가 시스템은 발전가능성이 있지만 임상문헌이나 근거가 부족한 의료기술을 평가하는 데 한계가 있어 대안이 필요하다고 강조했다.
이에 따라 신의료기술평가위원회에서 임상문헌이 부족한 연구단계의 기술을 3단계로 분류해 2~3단계에 해당하는 기술에 대해서는 지원체계가 필요하다는 설명이다.
특히 위급한 환자이거나 대체기술이 없는 등의 이유로 임상도입이 필요하나 낮은 수준의 문헌적 근거만 있어 유효성이 있다고 결론내리기 어려운 의료기술에 대해서는 한시적 승인을 고려해야 한다.
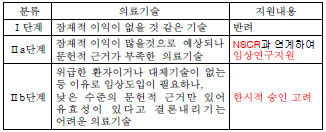
그는 "식약청 허가 전이나 식약청 허가와 동시에 신의료기술 평가를 진행해 승인기간을 줄이는 방향도 필요하다"면서 "현재 식약청과 논의 중에 있다"고 덧붙였다.
"신의료기술도 경제성 평가 필요하다"
이날 세미나에서는 신의료기술평가 제도를 발전시키기 위한 다양한 제안들이 나왔다.

이 교수는 건보공단에 대해서도 "보험자는 단순한 지불자가 아니라 비용효과적인 양질의 의료기술 구매자로서 역할을 적극 수행해야 한다"고 강조했다.
서울아산병원 임태환 교수는 신약이나 신의료기술의 경우 리스크가 있는 만큼 신의료기술평가를 규제의 측면에서만 접근해서는 안되며 산업적 측면을 고려해야 한다고 강조했다.
메드트로닉코리아 이상수 이사는 식약청 허가 전 신의료기술평가 신청 및 사전상담제도 도입, 개량적 기술은 평가범위에서 제외, 신의료기술 평가기간 단축, 신의료기술평가 교육 활성화 등을 제안했다.

정책 기사
- 복지부-의협-병협, '기능 재정립' 오늘 담판 2011-02-11 06:48:06
- 암 질환 첫 적정성 평가…대장암 등 3항목 2011-02-11 06:45:27
- 경실련 "심평원-금감원 업무협약 정보유출 우려" 2011-02-11 00:30:50
- 경북대병원 교수들 면허정지…행정처분 '수용' 2011-02-10 17:32:36
- 복지부, 야간·공휴일 진료 동네의원에 인센티브 2011-02-10 11:50:17









