오는 9월 허가변경 내용 적용…65세 이상 기준 핵심
같은 계열 치료제 기전 구분 및 기준 변경 득실 여부 핵심
지난해부터 안전성 이슈가 불거진 JAK(야누스키나제) 억제제 계열 치료제가 국내에서도 허가변경이 예고되면서 향후 영향이 불가피해 보인다.
9일 제약업계에 따르면 식품의약품안전처(이하 식약처)로부터 JAK 억제제 허가변경 명령 고지를 받고 허가변경절차를 밟고 있는 중이다.
식약처는 지난 7월 14일부터 29일까지 JAK 억제제의 의약품 허가변경명령 사전예고 기간을 가지고 지난 8월 1일부터 허가사항 변경을 공시했다.
근거는 미국 식품의약품청(FDA) 및 유럽 의약품청(EMA)의 JAK 억제제에 대한 안전성 정보와 국내·외 현황 그리고 중앙약사심의위원회 및 전문학회 자문 검토 결과로 식약처는 이에 대한 의견조회를 마쳤다는 설명이다.
실제 FDA는 젤잔즈의 시판후조사과정에서 혈전발생 가능성이 제기되면서 지난해 12월 젤잔즈 등의 JAK억제제의 사용은 TNF억제제 등의 치료제에 반응하지 않는 환자들에게 사용할 수 있도록 했다. 사실상 2차 치료제로 사용할 것을 권고한 셈이다.
이에 따라 의견조회 결과를 반영한 허가사항 변경이 확정됐으며, 각 제약사별 허가변경 절차가 마무리 된 이후 오는 9월 1일부터 허가변경사항이 적용될 예정이다.
허가변경 대상성분은 ▲토파시티닙(한국화이자, 젤잔즈) ▲아브로시티닙(한국화이자, 시빈코) ▲바리시티닙(한국릴리, 올루미언트) ▲필고티닙(한국에자이, 지셀레카) ▲유파다시티닙(한국애브비, 린버크) 등 5개 성분이다. 여기에 국내 제네릭 제품까지 포함하면 총 67개 품목이 변경될 예정이다.
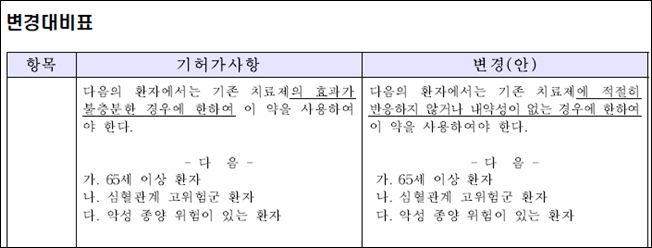
식약처가 공개한 허가사항 변경(안) 대비표 중 토파시티닙의 변경내용 일부를 살펴보면 기존의 '기존 치료제의 효과가 불충분한 경우에 한해' ▲65세 이상 환자 ▲심혈관계 고위험군 환자 ▲악성종양 위험이 있는 환자 등에게 허가돼 있었다.
하지만 허가변경 이후에는 '기존 치료제에 적절히 반응하지 않거나 내약성이 없는 경우에 한해' 치료제를 사용할 수 있도록 변경됐다. 일부 치료제에는 기존에 세부 내용이 없었던 65세 이상 환자, 심혈관계 고위험군 환자, 악성종양 위험이 있는 환자에 대한 구체적인 항목이 추가됐다.
제약업계 A관계자는 "규제기관이 식약처에서 허가사항 변경 명령이 떨어진 만큼 변경절차를 밝고 있는 중이다"며 "허가변경 영향에 대한 논의는 9월 이후 상황을 지켜볼 것으로 본다"고 말했다.
업계에 따르면 아직 건강보험심사평가원은 건강보험급여 문제는 허가변경 절차가 마무리된 이후 논의해보겠다는 입장. 이와 별개로 임상현장에서의 처방옵션 변경 여파도 예상되고 있다.
다만, 임상현장에서는 지난해 JAK억제제 안전성 이슈가 발생했을 당시 기존에 문제가 된 안전성 이슈가 충분히 관리가 가능했다는 입장을 밝혔던 만큼 향후 상황을 지켜봐야할 것으로 보인다.
당시 건국대병원 이상헌 교수(전 대한류마티스학회장) "당연히 급여 기준이 변경된다면 임상 현장에서 혼선이 많을 것으로 예상된다"며 "해당 안전성 이슈가 이미 인지하고 있던 부분이기 때문에 경고를 하고 환자 상황에 따라 의사에게 맡겨야한다는 게 개인적인 생각"이라고 말했다.
또 허가변경이 일괄적으로 이뤄지고 있지만 JAK 억제제 계열 치료제가 기존에 조금씩 차이가 있다는 점을 고려해야 된다는 의견도 존재했다.
상급종합병원 류마티스내과 A교수는 "JAK 억제제가 비슷한 계열이지만 일부 약물은 새롭게 출시됐고 정확히 판단할 만한 부작용 데이터 쌓이지 않았다"며 "전체 계열로 묶어 일반화하는 것은 의학적으로 볼 때 타당하지 않다는 생각은 있다"고 덧붙였다.








