아주의대 김유선 교수, '셀 리서치' 게재 "항암제 개발 기여"
국내 의과학자가 암세포를 사멸시키는 핵심 단백질 발현에 성공해 주목된다.

김유선 교수(좌)와 구기방 박사과정.(우)
미래창조과학부는 1일 "아주의대 생화학교실 김유선 교수(교신저자)와 구기방 박사과정(제1저자)이 세포사멸 프로그램(네크롭토시스) 한계점을 극복한 핵심 단백질(RIP3) 복구에 성공했다"고 밝혔다.
네크롭토시스(Necroptosis)는 RIP1, RIP3, MLKL 단백질에 의해 조절되는 세포사멸 프로그램이며, RIP3는 네크롭토시스 조절 핵심 단백질로 세린 트레오닌 인산화 효소이다.
그동안 RIP3는 고체형태 암에서 현저히 감소돼 새로운 암세포 사멸 전략으로 활용하는 데 한계가 있었다.
연구팀은 암세포에 탈메틸화제를 투여하는 새로운 방식을 도입해 암 발생으로 감소된 RIPS 복구에 성공했다.
탈메틸화제는 유전자(DNA)와 메틸기를 제거 또는 감소시키는 약물을 의미한다.
동물실험을 통해 고체 형태 암에 탈메틸화제를 투여해 RIP3 발현을 증가시킨 뒤 항암제를 투입한 결과, 항암제만 투여한 그룹에 비해 쥐 종양이 현저하게 줄어든 것을 확인했다.
또한 유방암 환자의 조직을 검사한 결과, RIP3 발현이 정상조직에 비해 현저히 저하된 것도 발견했다.
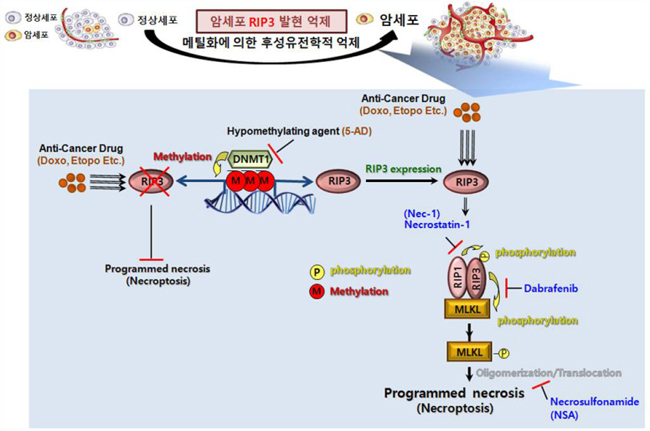
메틸화제 처리 및 네크롭토시스 암세포 사멸 유도 과정 모식도.
연구팀은 이번 성과가 유방암 등 인체 암세포에 적용돼 항암치료의 새로운 전략이 될 수 있는 가능성을 보였다고 평가했다.
김유선 교수팀의 연구는 네이처 자매지 셀 리서치(Cell Research) 5월 8일자 온라인 판에 게재됐으며, 국내외 관련 특허를 출원했다.
김유선 교수는 "단백질을 통해 암세포 자살을 유도하는 새로운 사멸 프로그램 실현 가능성을 한 단계 앞당긴 성과"라면서 "RIP3 조절을 통해 암세포 항암제 반응성을 높이고 효율적 암 치료제 개발에 큰 기여할 것으로 기대된다"고 말했다.
이번 연구는 미래부 기초연구사업(선도연구센터 및 중견연구자지원) 지원으로 수행됐다.

네크롭토시스(Necroptosis)는 RIP1, RIP3, MLKL 단백질에 의해 조절되는 세포사멸 프로그램이며, RIP3는 네크롭토시스 조절 핵심 단백질로 세린 트레오닌 인산화 효소이다.
그동안 RIP3는 고체형태 암에서 현저히 감소돼 새로운 암세포 사멸 전략으로 활용하는 데 한계가 있었다.
연구팀은 암세포에 탈메틸화제를 투여하는 새로운 방식을 도입해 암 발생으로 감소된 RIPS 복구에 성공했다.
탈메틸화제는 유전자(DNA)와 메틸기를 제거 또는 감소시키는 약물을 의미한다.
동물실험을 통해 고체 형태 암에 탈메틸화제를 투여해 RIP3 발현을 증가시킨 뒤 항암제를 투입한 결과, 항암제만 투여한 그룹에 비해 쥐 종양이 현저하게 줄어든 것을 확인했다.
또한 유방암 환자의 조직을 검사한 결과, RIP3 발현이 정상조직에 비해 현저히 저하된 것도 발견했다.

김유선 교수팀의 연구는 네이처 자매지 셀 리서치(Cell Research) 5월 8일자 온라인 판에 게재됐으며, 국내외 관련 특허를 출원했다.
김유선 교수는 "단백질을 통해 암세포 자살을 유도하는 새로운 사멸 프로그램 실현 가능성을 한 단계 앞당긴 성과"라면서 "RIP3 조절을 통해 암세포 항암제 반응성을 높이고 효율적 암 치료제 개발에 큰 기여할 것으로 기대된다"고 말했다.
이번 연구는 미래부 기초연구사업(선도연구센터 및 중견연구자지원) 지원으로 수행됐다.







