별도 평가트랙 도입 등 '신의료기술평가 규칙' 개정·시행
인공지능(AI)·빅데이터 등 융·복합 혁신의료기기 시장진입은 얼마나 앞당겨질까.
보건복지부(장관 박능후)는 혁신의료기술 별도평가트랙 도입 및 신의료기술 평가기간 단축을 골자로 한 '신의료기술평가에 관한 규칙(이하 신의료기술평가 규칙) 개정안을 오는 15일 공포·시행한다.
앞서 정부는 지난해 7월 의료기기 규제혁신 및 산업육성방안(의료기기 규제혁신 방안)을 통해 AI ·3D 프린팅·로봇 등 첨단기술이 융합된 혁신의료기술에 대해서는 기존 의료기술 평가방식이 아닌 별도 평가트랙 도입을 발표했다.
복지부는 후속조치로 지난해 9월부터 올해 1월까지 '혁신의료기술 별도 평가트랙' 시범사업을 실시해 이 결과를 바탕으로 신의료기술평가 규칙 개정안을 마련했다.
개정된 주요 법령 내용을 살펴보면 융·복합 첨단 의료기술 및 암·심장질환 등 중증질환을 치료하거나 환자 만족도를 높이는 등 사회적 활용가치가 높은 의료기술은 기존 신의료기술평가가 아닌 별도 평가트랙이 적용된다.
그동안 출판된 문헌을 근거로 이뤄진 신의료기술평가는 새로운 의료기술이 현장에 사용되기 전 기본적인 안전성과 유효성을 폭 넓게 검토한다는 장점이 있었다.
하지만 의료기술이 빠르게 변화하는 환경 속에서 혁신적인 의료기술의 조기 시장진입과 현장 활용을 지체시켜 의료기술 발전을 저해하고 있다는 의료기기업계 지적도 적지 않았다.
복지부와 한국보건의료연구원(NECA)은 업계 제도개선 목소리를 수렴해 의료기술의 사회적 가치 및 잠재성을 평가하는 방법을 연구해 기존 문헌 중심 평가체계를 보완하는 '잠재성 평가방법'을 개발했다.
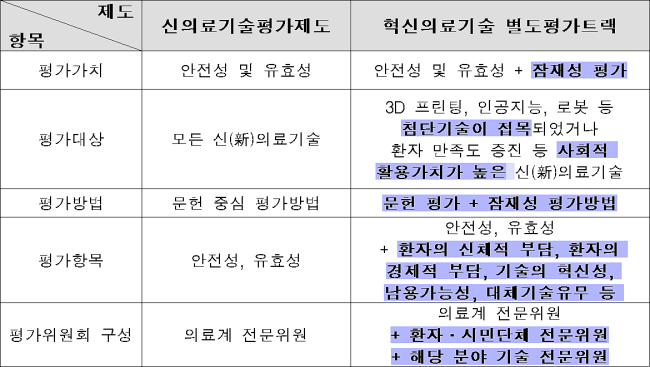
기존 신의료기술평가제도와 혁신의료기술 별도 평가트랙 비교
이를 적용한 혁신의료기술 별도 평가트랙에서는 기존 문헌 평가와 함께 새로 개발된 의료기술의 잠재성 평가까지 진행한다.
이는 기존 평가체계에서는 유효성을 평가할 문헌이 부족해 탈락했던 의료기술이라도 환자의 삶을 획기적으로 개선하거나 비용부담을 줄여주는 등 높은 잠재성을 인정받으면 조기 시장진입을 허용하겠다는 것.
다만 정부는 혁신의료기술이라 하더라도 사람의 인체조직 내부에 행해지는 침습적 의료행위로 환자 부담이 큰 의료기술의 경우 문헌을 통한 엄격한 안전성 검증을 실시하는 장치를 마련했다.
더불어 혁신의료기술 별도 평가트랙을 통해 의료현장에 도입된 혁신의료기술은 의료현장에서 활용된 결과를 바탕으로 3~5년 후 재평가를 받아야 한다.
따라서 혁신의료기술을 개발한 의료기기업체는 이를 사용하는 의료기관 및 사용 의사, 재평가를 위해 수집되는 자료 등을 NECA에 제출해야 한다.
만약 허위로 자료를 제출하거나 허용된 의료기관 이외에서 의료기술을 사용할 경우 혁신의료기술 사용이 중단될 수 있다.
한편, 복지부는 지난해 7월 정부 의료기기 규제혁신 방안에 포함됐던 신의료기술 평가기간도 기존 280일에서 250일로 30일 단축된다고 밝혔다.
전문가 서면 자문을 통해 신의료기술평가 대상 여부를 판단했던 평가절차를 내부 평가위원으로 대체함으로써 기존 2단계에서 1단계로 간소화했다는 설명이다.
손호준 보건복지부 의료자원정책과장은 "혁신의료기술 별도 평가트랙 도입을 통해 그간 늦어졌던 혁신의료기술 활용을 촉진하되 의료기술 안전성은 엄격히 검증할 예정"이라고 밝혔다.
덧붙여 "신의료기술 평가기간을 단축함으로써 다소 긴 평가기간으로 인해 어려움을 호소했던 의료기기업체들의 부담도 줄어들 것"이라고 내다봤다.
보건복지부(장관 박능후)는 혁신의료기술 별도평가트랙 도입 및 신의료기술 평가기간 단축을 골자로 한 '신의료기술평가에 관한 규칙(이하 신의료기술평가 규칙) 개정안을 오는 15일 공포·시행한다.
앞서 정부는 지난해 7월 의료기기 규제혁신 및 산업육성방안(의료기기 규제혁신 방안)을 통해 AI ·3D 프린팅·로봇 등 첨단기술이 융합된 혁신의료기술에 대해서는 기존 의료기술 평가방식이 아닌 별도 평가트랙 도입을 발표했다.
복지부는 후속조치로 지난해 9월부터 올해 1월까지 '혁신의료기술 별도 평가트랙' 시범사업을 실시해 이 결과를 바탕으로 신의료기술평가 규칙 개정안을 마련했다.
개정된 주요 법령 내용을 살펴보면 융·복합 첨단 의료기술 및 암·심장질환 등 중증질환을 치료하거나 환자 만족도를 높이는 등 사회적 활용가치가 높은 의료기술은 기존 신의료기술평가가 아닌 별도 평가트랙이 적용된다.
그동안 출판된 문헌을 근거로 이뤄진 신의료기술평가는 새로운 의료기술이 현장에 사용되기 전 기본적인 안전성과 유효성을 폭 넓게 검토한다는 장점이 있었다.
하지만 의료기술이 빠르게 변화하는 환경 속에서 혁신적인 의료기술의 조기 시장진입과 현장 활용을 지체시켜 의료기술 발전을 저해하고 있다는 의료기기업계 지적도 적지 않았다.
복지부와 한국보건의료연구원(NECA)은 업계 제도개선 목소리를 수렴해 의료기술의 사회적 가치 및 잠재성을 평가하는 방법을 연구해 기존 문헌 중심 평가체계를 보완하는 '잠재성 평가방법'을 개발했다.
이는 기존 평가체계에서는 유효성을 평가할 문헌이 부족해 탈락했던 의료기술이라도 환자의 삶을 획기적으로 개선하거나 비용부담을 줄여주는 등 높은 잠재성을 인정받으면 조기 시장진입을 허용하겠다는 것.
다만 정부는 혁신의료기술이라 하더라도 사람의 인체조직 내부에 행해지는 침습적 의료행위로 환자 부담이 큰 의료기술의 경우 문헌을 통한 엄격한 안전성 검증을 실시하는 장치를 마련했다.
더불어 혁신의료기술 별도 평가트랙을 통해 의료현장에 도입된 혁신의료기술은 의료현장에서 활용된 결과를 바탕으로 3~5년 후 재평가를 받아야 한다.
따라서 혁신의료기술을 개발한 의료기기업체는 이를 사용하는 의료기관 및 사용 의사, 재평가를 위해 수집되는 자료 등을 NECA에 제출해야 한다.
만약 허위로 자료를 제출하거나 허용된 의료기관 이외에서 의료기술을 사용할 경우 혁신의료기술 사용이 중단될 수 있다.
한편, 복지부는 지난해 7월 정부 의료기기 규제혁신 방안에 포함됐던 신의료기술 평가기간도 기존 280일에서 250일로 30일 단축된다고 밝혔다.
전문가 서면 자문을 통해 신의료기술평가 대상 여부를 판단했던 평가절차를 내부 평가위원으로 대체함으로써 기존 2단계에서 1단계로 간소화했다는 설명이다.
손호준 보건복지부 의료자원정책과장은 "혁신의료기술 별도 평가트랙 도입을 통해 그간 늦어졌던 혁신의료기술 활용을 촉진하되 의료기술 안전성은 엄격히 검증할 예정"이라고 밝혔다.
덧붙여 "신의료기술 평가기간을 단축함으로써 다소 긴 평가기간으로 인해 어려움을 호소했던 의료기기업체들의 부담도 줄어들 것"이라고 내다봤다.







