임상 수행 과정 안전성·객관성·투명성 확보 목표
10월 26일 이후 승인 임상부터 적용키로
임상 정보 등록, 공개 제도가 10월부터 시행된다. 임상 승인 정보와 진행 현황을 온라인에서 확인할 수 있어 임상 수행 과정의 안전성, 객관성 등을 담보한다는 취지다.
25일 식품의약품안전처는 안전관리 강화와 절차적 규제 합리화를 골자로 하는 '하반기 의약품 주요 정책'을 공개했다.
먼저 환자 맞춤형 임상시험 정보 제공으로 치료약이 없는 환자의 임상시험 참여를 지원하고 임상시험 수행과정의 안전성‧객관성‧투명성을 확보하기 위한 임상시험 정보 등록·공개 제도가 10월부터 시행된다.
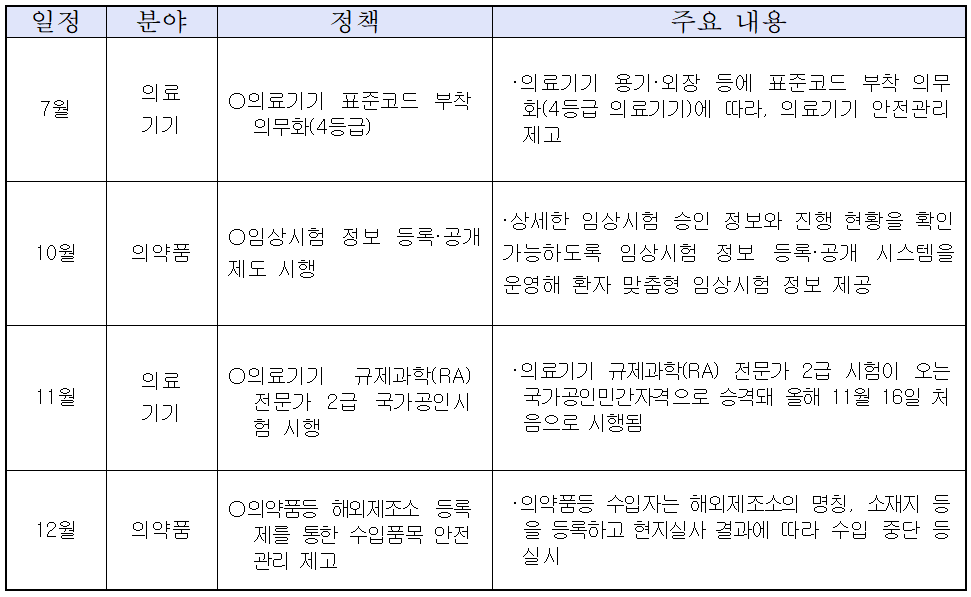
2019년 하반기 주요 안전정책 추진 일정
10월 26일 이후 승인되는 임상시험은 의약품통합정보시스템에서 임상 승인 정보와 진행 현황 등이 확인 가능하다.
이에 식약처는 임상시험 정보 등록 방법 및 관련 용어에 대한 가이드라인을 마련할 예정이다.
한편 해외 의약품 제조소 등록제도 시행된다.
수입의약품에 대한 체계적인 관리체계를 구축하고 현지실사를 통해 위해발생 우려가 있는 경우 수입중단 등 실효성 있는 조치를 실시하기 위해 의약품을 생산하는 해외제조소의 명칭 및 소재지 등을 등록하는 해외제조소 등록제를 12월부터 시행한다.
의료제품 분야는 ▲의료기기 표준코드 부착 의무화(7월) ▲임상시험 정보 등록·공개 제도 시행(10월) ▲의료기기 규제과학(RA) 국가공인시험(11월) ▲의약품등 해외제조소 등록제(12월) 등이 시행된다.
의료기기 표준코드 부착 의무화의 본격 시행('19.7.1, 4등급)으로 허가부터 유통‧사용까지 각 단계별 정보를 통합 관리하는 전주기 통합 안전관리가 실시된다.
기존 민간자격으로 운영했던 의료기기 규제과학(RA) 전문가 2급 시험이 국가공인민간자격으로 승격돼 2019년 11월 16일 처음으로 시행된다.
의료기기 규제과학(RA) 전문가는 의료기기 개발부터 제품화 및 시판 후 관리 등에 필요한 '법적·과학적 규제기준'에 대한 전반적 지식을 갖춘 자를 뜻한다.
25일 식품의약품안전처는 안전관리 강화와 절차적 규제 합리화를 골자로 하는 '하반기 의약품 주요 정책'을 공개했다.
먼저 환자 맞춤형 임상시험 정보 제공으로 치료약이 없는 환자의 임상시험 참여를 지원하고 임상시험 수행과정의 안전성‧객관성‧투명성을 확보하기 위한 임상시험 정보 등록·공개 제도가 10월부터 시행된다.
이에 식약처는 임상시험 정보 등록 방법 및 관련 용어에 대한 가이드라인을 마련할 예정이다.
한편 해외 의약품 제조소 등록제도 시행된다.
수입의약품에 대한 체계적인 관리체계를 구축하고 현지실사를 통해 위해발생 우려가 있는 경우 수입중단 등 실효성 있는 조치를 실시하기 위해 의약품을 생산하는 해외제조소의 명칭 및 소재지 등을 등록하는 해외제조소 등록제를 12월부터 시행한다.
의료제품 분야는 ▲의료기기 표준코드 부착 의무화(7월) ▲임상시험 정보 등록·공개 제도 시행(10월) ▲의료기기 규제과학(RA) 국가공인시험(11월) ▲의약품등 해외제조소 등록제(12월) 등이 시행된다.
의료기기 표준코드 부착 의무화의 본격 시행('19.7.1, 4등급)으로 허가부터 유통‧사용까지 각 단계별 정보를 통합 관리하는 전주기 통합 안전관리가 실시된다.
기존 민간자격으로 운영했던 의료기기 규제과학(RA) 전문가 2급 시험이 국가공인민간자격으로 승격돼 2019년 11월 16일 처음으로 시행된다.
의료기기 규제과학(RA) 전문가는 의료기기 개발부터 제품화 및 시판 후 관리 등에 필요한 '법적·과학적 규제기준'에 대한 전반적 지식을 갖춘 자를 뜻한다.








