식약처, 의료기기 맞춤형 신속 분류제도 도입 추진
신속 임상 지원 플랫폼 등 신속한 시장 진입 지원사격
식품의약품안전처가 글로벌 바이오·디지털헬스 국가로 도약하기 위해 규제혁신 100대 과제를 선정했다.
11일 식약처는 대한상공회의소, 한국소비자단체협의회와 함께 국민 건강과 안전을 최우선으로 두면서 산업 발전을 지원하기 위한 '식의약 규제혁신 100대 과제'를 대한상공회의소에서 발표했다.
이번 규제혁신 과제는 새 정부 국정과제인 '바이오‧디지털 헬스 글로벌 중심국가 도약'을 위한 추진전략의 일환으로 혁신 제품의 신속한 시장 진입 지원을 위한 신제품 개발 활성화와 국내 식의약 산업의 글로벌 경쟁력 강화를 지원하고 안전·건강과 직결되지 않으면서 시대·환경 변화에 맞지 않고 기업 활동에도 불합리·불필요한 규제는 과감히 폐지, 완화하기 위해 마련됐다.
식의약 규제혁신 100대 과제는 ▲신산업 지원(19건) ▲민생불편·부담 개선(45건) ▲국제조화(13건) ▲절차적 규제 해소(23건) 4개 분야다.
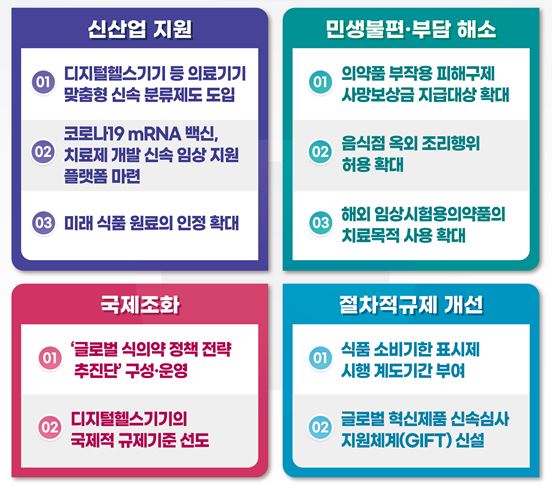
먼저 신산업 지원에서 디지털헬스기기 등 의료기기 맞춤형 신속 분류제도를 도입한다.
현재 신개발, 융복합 등 새롭게 개발된 의료기기는 품목 분류와 등급 결정 등에 장시간 소요돼 신속한 제품화에 어려움이 있었다. 이를 개선하기 위해 품목을 고시화하기 전이라도 신속 분류할 수 있도록 '한시 품목' 분류제도를 도입한다.
품목 분류가 없는 신개발 의료기기 등은 한시 품목으로 허가 신청과 동시에 제품의 위해성이나 사용목적, 성능, 작용원리 등을 고려해 품목 신설 절차를 진행해 신속하게 제품화될 수 있도록 개선한다.
코로나19 mRNA 백신·치료제 개발을 위한 '신속 임상 지원 플랫폼'도 마련된다.
지속적이고 다양하게 출현하고 있는 코로나19 바이러스 변이주에 대응하기 위한 백신과 치료제의 신속한 개발이 요구되고 있다는 점에서 식약처는 '신속 임상 지원 플랫폼'을 마련하겠다는 방침.
이를 위해 ▲코로나19 임상시험용 mRNA 백신 생산에 연구용 세포주를 이용할 수 있도록 하고, ▲코로나19 변이 등 질병 특성 변화를 고려한 치료제 임상 평가지표를 마련해 임상시험계획 심사·승인 단계를 간소화한다.
민생불편·부담 개선 부분에서는 의약품 부작용 피해구제 사망보상금 지급대상 확대가 추진된다. 현재 사망보상금의 경우 명백한 인과관계가 있는 경우에만 지급하고 있지만 앞으로는 상당한 인과성이 인정되는 경우까지도 연령 또는 기저질환 등을 고려해 사망보상금을 차등 지급할 수 있도록 했다.
해외 임상시험용의약품의 치료목적 사용 확대를 통해 기존엔 국내 승인된 임상시험용의약품만 치료목적사용 승인 신청이 가능했지만 국내·외에서 승인된 임상시험용의약품을 치료목적사용 승인 신청할 수 있도록 확대한다.
이외 식약처는 글로벌 혁신제품 신속심사 지원체계(GIFT) 신설, 국내 임상평가 가이드라인 국제기준에 반영, '글로벌 식의약 정책 전략 추진단' 운영 등의 규제개혁 과제를 공개했다.








