마드리갈 파마슈티컬스, 3상 탑라인 결과 공개
NAS 개선도 26~30% 등 용량 의존적으로 효과↑
미국 마드리갈 파마슈티컬스(Madrigal Pharmaceuticals)가 비알콜성지방간염(Non-alcoholic steatohepatitis, NASH) 신약 후보 물질 임상 3상에 성공하면서 세계 첫 NASH 치료제 타이틀에 한발 더 다가섰다.
전세계 수십 곳의 제약사가 NASH 개발에 돌입했지만 개발에 실패하거나 진행중이어서 아직까지 적절한 NASH 치료제는 없는 상황. 시장 규모도 세계적으로 37조원 대 이상으로 평가되는 등 개발 성공 여부에 대한 환자 및 의료진 모두 관심이 집중되고 있다.
마드리갈 사가 개발중인 갑상선 호르몬 수용체 작용제 레스메티롬(Resmetirom)의 MAESTRO-NASH 임상 3상 탑라인 결과가 현지 시간 19일 공개됐다.
비알코올성 지방간은 인슐린이 제 역할을 하지 못해 간에 과도한 지방이 축적되면서 발생하는데 이후 간세포 괴사, 염증 반응을 동반한 지방간염에서 간경변증으로 발전한다.
임상은 NASH 간경화를 가진 950명 이상의 환자에서 간 분해 증상으로의 진행을 비침습적으로 측정하도록 설계된 이중맹검, 무작위, 위약 대조 연구다.
생검으로 섬유증 정도가 다른 NASH 환자들을 선별, 무작위 할당해 일 80mg, 100mg, 위약을 투약한 후 52주 째 추가 생검을 실시했다.
1차 연구 종말점은 NAS(NAFLD Activity Score)에서 2점 이상 감소하는 NASH 관해(NAFLD Activity Score)이며, 섬유증 악화 또는 NAS 악화 없이 섬유증 감소 역시 임상 성공으로 간주된다.
무작위 배정된 966명의 환자의 기본 간 생검 섬유증 정도는 F3(60%), F2(35%), F1B(5%)로 구성됐고 이들의 84%는 NAS ≥ 5의 점수를 가지고 있었다.
투약 이후 955명의 환자를 대상으로 52주차에 조직학적 반응을 평가했다. NASH 규제 지침에 따라 코로나 감염 관련으로 11명의 ITT 환자는 제외시켰다.
분석 결과 생검 연구 종말점에서 레스메티롬 두 용량 모두 통계적으로 유의한 반응을 보였다.
F2, F3 및 F2/F3 환자의 하위 그룹에서 두 용량 모두 유사한 통계적 유의성과 효과 크기를 포함해 섬유증 단계 또는 당뇨병 상태와 무관하게 생검 연구 종말점을 달성했다.
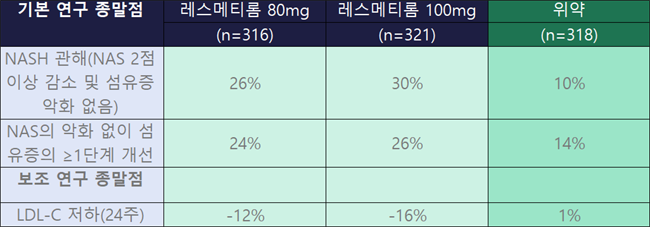
80mg(n=316)에서 NASH 개선도는 26%, 100mg(n=321)은 30%, NAS의 악화없이 섬유증의 1단계 이상 개선은 각각 24%, 26%, LDL-C 저하는 -12%, -16%로 용량 의존적으로 효과가 강화됐다.
이어 간 효소(ALT, AST 및 GGT)도 기준선 대비 통계적으로 유의미한 감소가 나타나 다양한 2차 평가 지표를 달성했다.
위약과 비교해 레스메티롬 치료군에서 죽종형성 지질 및 지단백질, 섬유증 바이오마커 및 영상 검사(MRI-PDFF, CAP 및 간 경직도 측정)의 감소도 관찰됐다.
레스메티롬은 경미하고 일시적인 과도한 설사 등의 부작용만 보고돼 80mg 및 100mg 용량 모두 안전한 것으로 나타났다.
심각한 부작용(SAE)의 빈도는 치료군 전체에서 비슷했고 80mg, 100mg 및 위약 그룹에서 각각 11.8%, 12.7% 및 12.1%였다. 부작용으로 인한 연구 중단 비율은 80mg, 100mg 및 위약 그룹에서 각각 2.8%, 7.7% 및 3.7%이었다.
연구진은 해당 내용을 향후 학술대회에서 전체 내용을 발표하고 국제 저널에도 게재할 예정이다.








