기획①희귀약 잠재성 무궁무진…진단 기술 발달·신속 허가 이점
글로벌 보고서마다 2020년 처방약 매출액 전망치는 다르다. 어찌보면 천차만별이다. 하지만 공통점이 있다. 점점 고지혈증약 등 만성질환약은 순위 상위권에서 이탈하고 항암제 등 희귀질환약이 강세를 보인다는 점이다. 환자는 없지만 잠재성은 큰 시장. 수년전부터 거대 공룡 다국적제약사들은 이 부분을 주목하고 있다.신약 개발 등 필수의약품 공급, 그리고 공중 보건 이바지. 거창하지만 제약사 역할 중 하나다. 하지만 톡 까놓고 말해 몇 없는 환자를 위해 많게는 조단위의 투자금을 기꺼이 쏟아붓는 제약사는 드물다. 사명감 하나로 손해 보는 의약품 만들기는 쉽지 않다는 소리다.
1. 글로벌 공룡 제약사는 왜 환자 없는 시장에 열광하는가
2. "난 너만 좋아해" 집착이 용서되는 암 퇴치 용사들
그런데 글로벌 공룡 제약사들이 환자 없는 시장에 열광하고 있다. 너도 나도 팔을 걷어부치며 열과 성의를 다해 신약을 만든다.

글로벌 흐름을 보자. 희귀의약품 지위는 나날이 격상된다. 2020년 글로벌 처방약 마켓의 20%를 넘는다는 보고서들이 많다. 이것도 제네릭 매출은 제외된 보수적 접근이다.
2014년부터 2020년까지 연 평균 성장률은 10% 이상으로 전체 처방약 5%를 두 배 이상 상회한다. (자료 출처: 제약·생명공학 전문 컨설팅업체 이밸류에이트 파마) 희귀의약품이 전체 시장에서 더 이상 틈새가 아니라는 대목이다.
등장한 지 얼마 안된 백혈병 및 림프종 치료제 '임브루비카(이브루티닙)'.
가장 유망한 희귀의약품 중 하나로 꼽힌다. 2020년 처방액은 무려 82억 달러(9조8360억원)에 달할 것으로 전망된다. (자료 출처: 제약시장 분석기관 퍼스트워드파마)
이 약 역시 대상 환자는 적다. '임브루비카'로 치료가 가능한 외투(맨틀)세포림프종은 국내 전체 암 발생의 2%에 불과한 비호지킨 림프종 중에서도 3% 정도의 희귀질환이다. 하지만 불과 5년 뒤 글로벌 처방액은 10조원에 육박하게 된다.
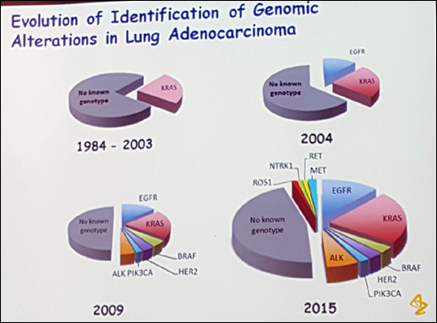
불과 몇 년전만해도 폐암약 하면 폐암약이던 치료제가 비소세포폐암만 봐도 특정 유전자 변이에 따라 EGFR, ALK 등으로 약제 선택이 달라진다. 더 이상 나올 약이 없을 거 같던 제약산업에 신약이 매년 탄생하는 이유도 이 때문이다.
삼성서울병원 병리과 최윤라 교수는 "과거에는 암 모양을 중요하게 생각했지만 최근은 개인 유전자 변이에 다른 차이가 더 큰 것으로 본다. 이제는 유전자 변이 형태가 더욱 중요해지고 알아야만 하는 시대가 됐다"고 강조했다.
서울아산병원 종양내과 윤덕현 교수도 "진단 기술 발달로 소수의 환자지만 맞춤별 치료제가 탄생하고 있다. 임브루비카도 같은 맥락"이라고 말했다.
참고로 작년 미국 승인 신약은 총 45개로 지난 19년만에 최고 기록을 수립했다. 이중 항암제가 15개로 주를 이뤘다.
환자 없는 희귀약…허가도 LTE급
지난해 미국 FDA 허가 신약 중 절반 이상이 4가지 대체승인절차(신속 개발, 혁신적 치료, 우선 심사, 신속 승인) 중 하나를 이용했다.
특히 혁신적 치료(Breakthrough Therapy) 절차는 실질적 개선을 입증한 데이터를 제출하면 FDA가 2개월 내 심사 여부를 결정한다. 여기서 허가가 나면 심사관과 제약 기업이 지속적인 상호작용을 통해 최종 승인이 이뤄진다. 통상 6~10개월이 소요된다.
스티븐 갤슨 암젠 글로벌 규제 업무 및 안전성 담당 수석 부사장은 "지난 20년간 유럽과 미국에서 도입된 신속허가 절차들은 굉장히 긍정적인 영향을 미쳤다. 환자는 혁신적인 치료제 접근성 향상을, 제약사는 규제 당국, 학계와의 파트너십을 더욱 공고히하며 혁신 속도를 더욱 빠르게 할 수 있었다"고 평가했다.
한국에서 시판 승인 된 암젠 급성 림프모구성 백혈병 치료제(ALL) '블린사이토(블리나투모맙)'도 대표적인 예다. 이 약은 미국에서 혁신적인 치료제 지정을 통해 일반적인 과정보다 5.5 개월을 단축해 FDA 승인을 획득했다.
희귀의약품 전문 다국적제약사 관계자는 "희귀약은 적용 대상군이 적지만 시장성은 무궁무진하다. 진단 기술 발달로 표적 치료제가 각광받고 있고 신속 허가 이점도 있다. 경쟁이 치열하지도 않다. 공룡 글로벌 제약사들이 너도나도 희귀약 개발에 열광하는 이유"라고 판단했다.







