식약처, 정책 설명회 통해 현장 조사 기본 방침 공개
항암제·소아청소년 대상 임상 등 고위험군 집중 예고
올해 임상시험실태조사에서 서류 평가 대신 위험도 기반의 평가가 도입된다.
과거 시설, 인력 현황 등을 서류로 평가했다면 새롭게 바뀐 실태조사는 실제 진행중인 임상을 선정, 임상시험의 적절성을 점검하는 등 실제성에 더 부합하는 방향으로 개선했다.
22일 식품의약품안전처는 의약품 임상시험 온라인 정책설명회를 개최하고 임상시험 정책 방향부터 임상기관 실태조사 기본계획 등을 공개했다.
2022년도 실태조사 기본계획은 ▲임상시험실시기관 정기 실태조사 ▲품목허가 임상시험 실태조사 ▲안전성 정보 관리체계 조사로 이뤄진다.
먼저 임상시험실시기관 정기 실태조사는 위험도에 기반한 현장조사로 설정됐다. 진행중인 임상시험을 선정해 점검함으로써 해당 기관의 임상시험관리의 적절성을 살피게된다.
변정아 임상정책과 연구원은 "정기실태조사가 가장 많이 바뀌었다"며 "작년까지 최근 3년간은 시설, 인력 현황, IRB를 서류로 분석 평가했다면 올해부터는 위험도 기반으로 진행중인 임상을 선정해 직접 보게된다"고 설명했다.
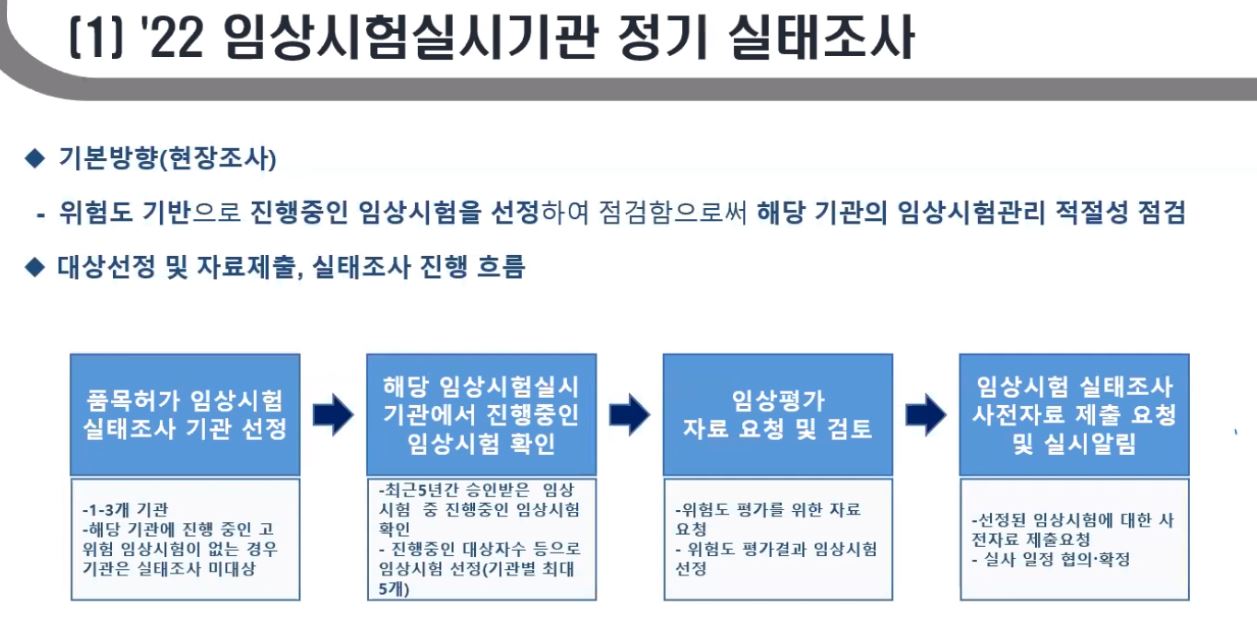
그는 "해당 기관이 평소에 임상시험을 적절히 관리하는지 보기 위해서 진행중인 임상시험을 선정해 보는 것으로 변경했다"며 "진행 흐름은 대상 선정 및 자료제출, 실태조사의 방향으로 진행하고 규정위반 시 행정처분을, 시정조치 사항이 있는 경우 추가 자료 제출을 지시한다"고 밝혔다.
식약처는 품목허가 임상시험 실태조사 실시 기관으로 1~3개 기관을 지정한다. 해당 기관에서 진행중인 고위험 임상시험이 없는 경우 기관은 실태조사 지정에서 제외된다.
고위험 임상시험은 초기 항암제 임상 및 소아청소년 대상 임상 등이다. 또 임상시험 계획서의 위반, 중대한 이상반응, 시험책임자의 임상수행 경험, 등록현황 등도 고려 사항이다.
특히 피해보상 절차 심의, 이해상충 관리 등 IRB 심사 및 운영 사항을 중점 조사한다는 것이 식약처의 계획.
이후 해당 임상시험실시기관에서 최근 5년간 승인받은 임상 시험 중 진행중 임상을 대상으로 대상자 수 등을 기준으로 기관별 최대 5개 임상을 선정, 위험도 평가를 위한 자료를 요청한다.
임상시험 ▲제출 자료는 IRB 소개, 임상시험대상자 확보/위임, 시험담당자 교육훈련, 시험과정 요약, 계획서 위반 및 이상반응 현황 요약이고 ▲사전제출자료는 IRB, 동의서, 피해자보상규약 및 보험가입, 임상시험 관련 인력/자격, 계획서 미준수 목록, SAE 목록, 의약품 인수/반납/재고기록 및 보관 일탈 상황, 리라벨링 현황기록이다.
식약처는 제출받은 임상시험 자료로 위험도를 평가해 최종 임상시험 점검 대상을 선정해 실태조사를 나가게된다.
변 연구원은 "기관별 5개 임상에 대해 자료를 요청하는데 이는 임상평가 자료와 유사하다"며 "이를 평가를 해서 그중에서 한개의 임상시험을 선택하고 선정된 임상에 대한 사전자료 제출 및 실사 일정을 협의해 확정하게 된다"고 설명했다.








