중등도~중증 플라크 건선에 적응증 확보
PASI 75 달성률 58%…위약군 대비 유의미
미국 FDA가 차세대 건선 치료제로 꼽히는 JAK 억제제 계열 듀크라바시티닙을 지난 9일 승인했다.
경구용 선택적 티로신인산화효소2(TYK2) 억제제인 듀크라바시티닙은 면역 반응 인자인 인터류킨(IL)-12, IL-23, 인터페론 등의 신호전달 경로에 관여하는 기전을 갖고 있다.
신호전달 경로를 선택적으로 억제하기 때문에 심혈관계 질환 위험성이 보고된 JAK 억제제 대비 상대적으로 안전한 것으로 알려졌다.
승인된 적응증은 중등도에서 중증 플라크 건선으로 해당 등급에 대한 치료제는 현재 듀크라바시티닙이 유일하다.
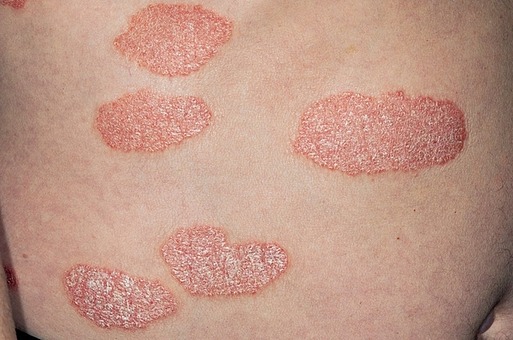
이번 승인은 중등도에서 중증 플라크 건선을 가진 약 1700명의 성인을 대상으로 한 3상 임상 POETYK PSO-1과 POETYK PSO-2 결과에 기초했다.
임상 결과 듀크라바시티닙을 매일 한 번 사용한 치료는 위약 및 아프레밀라스트와 비교해 피부 개선도 및 증상 면에서 임상적으로 유의미한 향상을 보였다.
두 임상에서 환자는 무작위로 듀크라바시티닙이나 위약 또는 건선에 대해 승인된 경구 포스포디에스테라아제4 억제제인 아프레밀라스트 30mg을 매일 2회 투여받았다.
주요 종말점은 건선 영역 및 심각도 지수(PASI) 75 지표 달성 환자 백분율과 16주 동안의 글로벌 건선 평가 척도(sPGA) 점수였다.
투약 16주후 듀크라바시티닙 투약군의 PASI 75 달성 비율은 53~58%로 위약군의 9~13% 대비 유의미한 상승률을 기록했다. 기존 치료제인 아프레밀라스트의 달성률은 35~40%에 그쳤다.
두 임상 모두 치료를 계속 받은 환자들은 52주 동안 PASI 75 반응 달성률을 유지했다.
이어 듀크라바시티닙 복용군의 50~54%에서 16주 동안 0/1의 sPGA를 달성한 반면 위약군은 7~9%, 아프레밀라스트는 32~34%를 기록했다.
투약군의 일반적인 부작용은 상기도 감염(19.2%), 혈청 크레아틴 포스포키나아제(2.7%), 단순 헤르페스(2%), 구강 궤양(1.9%), 모낭염(1.7%)이었다. 치료 중단을 초래하는 부작용은 위약군에서 3.8%, 듀크라바시티니브군 2.4%, 아프레밀라스트군 5.2%에서 보고됐다.
듀크라바시티닙은 건선성 관절염, 낭창, 염증성 장질환에 대한 임상도 진행돼 향후 적응증이 확장될 가능성도 있다.








