[초점] 1년 치료에도 세 명 중 한 명 관해 달성으로 기대감↓
터제파타이드 등 후발 주자들, 효과 내세우며 추격전 예고

신약의 무덤으로까지 일컬어지던 MASH(대사이상관련 지방간염) 분야에서 미국 FDA의 승인을 받은 최초의 신약(레스메티롬)이 탄생했지만 정작 임상 현장은 시큰둥한 반응이 나오고 있다.
다국적제약사가 신약을 개발하는 경우 승인 이후 각 나라별 상황에 맞춰 급여, 비급여 출시 등 상용화 전략을 결정하고 가격 협상, 랜딩 코드 부여 등의 과정을 거쳐 실제 병의원에서 처방이 가능하기까지 짧게는 1년, 길게는 4년 이상 걸리기도 한다.
수십년간 신약이 없었던 분야에선 첫 신약이 탄생하면 처방에 대해 임상의는 물론 환자들에서도 기대감이 고조되는 것이 보통이지만 신약 레스메티롬의 경우 MASH 치료제로서 물꼬를 텄다는 상징적인 의미가 크다는 게 전문가들의 평.
오히려 후발주자들이 내놓은 임상 결과들이 상대적으로 우위를 가졌다는 평가까지 나오면서 '첫 신약'이라는 타이틀의 의미가 퇴색되고 있다는 이야기까지 나온다.
전문가들이 본 레스메티롬 임상 3상의 의미와 후발주자들과의 상대적 경쟁력 등 향후 상업적 성공 가능성에 대해 점검했다.
■난공불락 MASH 분야 첫 신약, 레스메티롬은 어떤 약?
지난 3월 미국 FDA는 간 섬유증 중등도 진행성 MASH에 사용할 수 있도록 마드리갈 파마슈티컬스가 개발한 레스메티롬(상품명 레즈디프라)를 승인한 바 있다.
3상은 조직검사에서 확인된 MASH와 F1B, F2 또는 F3의 섬유화 단계(F0 섬유화 없음~F4 간경화)를 가진 성인을 대상으로 1:1:1 비율로 무작위 배정해 레스메티롬 80mg, 100mg 또는 위약을 하루 한 번 52주간 투약케 했다.
총 966명의 환자를 80mg 레스메티롬 그룹 322명, 100mg 레스메티롬 그룹 323명, 위약 그룹 321명으로 나눠 투약한 결과 80mg에서 25.9%, 100mg에서 29.9%가 섬유증 악화가 없는 MASH 관해를 달성한 반면 위약 그룹은 9.7%에 그쳤다.
이어 80mg 레스메티롬 그룹 환자의 24.2%와 100mg 레스메티롬 그룹 환자의 25.9%에서 MAFLD 활동 점수의 악화 없이 적어도 한 단계 이상 섬유증 개선이 나타났다.
FDA는 "임상 12개월째에 간 생검에서 레즈디프라로 치료받은 피험자의 더 많은 비율이 위약을 투여받은 피험자에 비해 MASH 관해 또는 간 흉터 개선을 달성한 것으로 나타났다"고 밝혔다.
눈에 띄는 간 흉터가 있는 MASH 환자의 간 손상을 직접 해결할 수 있는 약물이 과거에는 없었지만 이번 승인을 통해 처음으로 환자들에게 식이요법과 운동 외에도 치료 옵션이 생긴 것.
■"첫 치료 옵션 등장" VS "임상적 효과 크지 않아"
레스메티롬의 임상 결과에 대해 전문가들의 평가는 양분된다.
첫 MASH 치료 옵션이 생겼다는 점에서는 긍정적이지만 실제 효과가 기대치에 못 미친다는 부정적인 목소리도 나오는 것.
일각에선 '첫 신약'이라는 타이틀만 챙기고 실익없이 상용화를 포기했던 바이오젠사의 치매 신약 아두헬름(성분명 아두카누맙)의 전철을 밟을 수 있다는 의견까지 제시하고 있다.
대한간학회 관계자는 "MASH 치료제가 없는 상황을 감안하면 레스메티롬의 효과는 완전히 좋다고 평가할 정도는 아니지만 섬유화를 호전시키는 약물로는 의미가 있다"며 "다만 조직학적 호전 여부를 보지 못한 점과 장기 안전성 문제는 숙제로 남았다"고 말했다.
그는 "지방간 치료제가 거의 없는 실정을 감안하면 3상에서 이 정도 효과를 보인 부분은 임상의로서 환영할만한 내용"이라며 "첫 MASH 치료제 탄생에 많은 의료진들이 기대감을 가지고 있다"고 덧붙였다.
반면 임상적으로 큰 의미가 없다는 부정적 견해도 만만찮다.
A대학병원 내분비내과 교수는 "치료 옵션이 새로 생겼다는 부분은 누구라도 긍정할 만한 내용"이라며 "반면 임상적 효과는 기대에 많이 못미친다"고 지적했다.
그는 "MASH 관해의 절대적인 수치는 25.9~29.9%로 적지 않치만 심지어 위약도 관해율이 9.7%에 달한다"며 "레스메티롬 투약군에서 위약의 관해율 퍼센티지를 뺀 상대적인 관해율은 16~20%에 그친다"고 말했다.
그는 "MAFLD 활동 점수의 악화 없이 적어도 한 단계 이상 섬유증 개선 부분도 마찬가지"라며 "위약의 개선율이 14.2%인데 레스메티롬은 24~25.9%이기 때문에 실제 약제의 상대적인 효과는 고작 10% 남짓에 그친다"고 꼬집었다.
임상 3상 결과만 놓고 보면 레스메티롬으로 1년간 치료한 경우 약 세 명에서 네 명을 치료해야 한 명에서 MASH 관해를 달성할 수 있고, MAFLD 활동 점수의 악화 없이 적어도 한 단계 이상 섬유증 개선 부분도 이와 비슷하다는 것.
A 교수는 "약물의 효과를 판별하는 잣대는 임상적 유의성과 효과 크기, 위험 대비 혜택, 비용-효과성 등 요소가 있다"며 "레스메티롬의 경우 위약 대비 효과의 통계적 유의성은 확보했지만 나머지 요소에선 기대감이 많이 떨어지는 게 사실"이라고 말했다.
그는 "만일 급여화가 된다고 해도 신약이라는 점을 고려하면 저렴하게 장기간 광범위한 처방을 기대하기도 어렵다"며 "특히 후발주자들이 내놓는 여러 임상 결과를 놓고 보면 상대적인 입지가 더욱 좁아진다"고 평가했다.
■첫 신약 타이틀은 상처뿐인 영광? 아두헬름 전철 가능성
일각에선 레스메티롬이 치매 신약 아두헬름의 전철을 밟을 수 있다는 전망도 내놓는다.
후발주자들이 앞다퉈 내놓는 임상 결과들이 상대적으로 우위에 있는 것으로 판단되면서 레스메티롬의 상용화 및 상업적 성공 가능성에 먹구름을 드리우고 있는 것.
효과 면에서 돋보이는 건 아케로 테라퓨틱스사는 지방간질환 치료제로 개발중인 신약후보물질 에프럭시퍼민(efruxifermin)이다.
섬유증 2기 또는 3기의 생검으로 확인된 성인 MASH 환자를 대상으로 HARMONY 임상2b 탑라인 96주차 결과를 보면 MASH 악화 없이 1단계 이상 섬유증 개선 비율은 최대 75%, MASH 악화 없이 2단계 이상 섬유증 개선 비율은 최대 36%, 섬유증 악화없이 MASH 관해 비율은 최대 62%에 달한다.
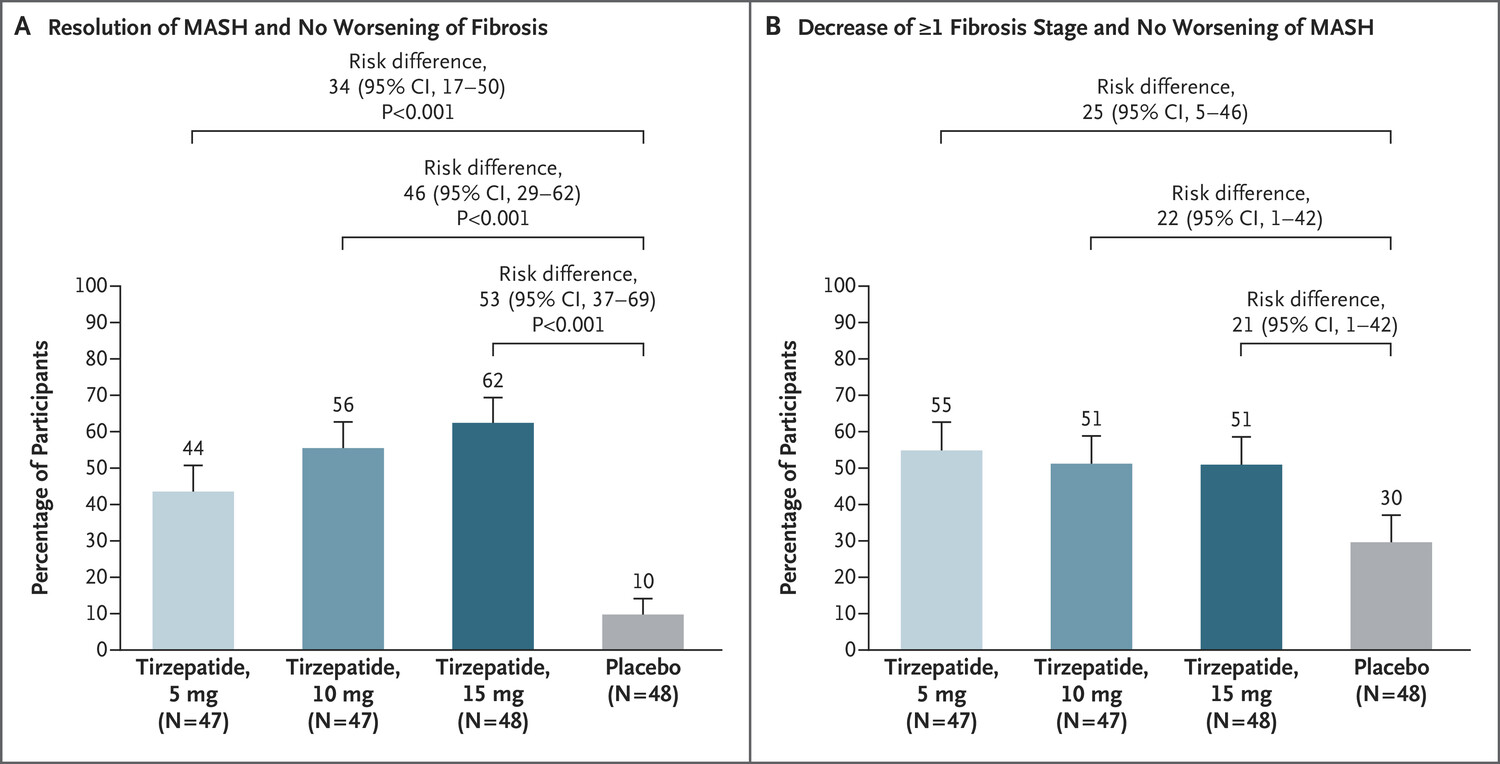
이달 국제학술지 NEJM에 하루 간격으로 MASH 신약후보물질 서보두타이드와 터제파타이드가 성공적인 임상 2상 결과를 공개하며 3상 진입을 예고한 것도 레스메티롬엔 부담이다.
생검으로 확인된 MASH 및 섬유화 단계 F1~F3를 가진 참가자에게 48주간 서보두타이드를 투약한 결과 섬유증 악화 없이 MASH의 개선은 최대 62%, 간 지방량의 최소 30% 감소 달성률은 최대 67%를 기록했다.
당뇨병치료제에서 비만치료제로 덩치를 키운 GIP·GLP-1 이중작용제 터제파타이드도 MASH 치료에서 괄목할만한 효과로 눈도장을 찍었다.
MASH 및 F2 또는 F3 단계(중간 또는 심각한) 섬유증을 가진 참가자를 대상으로 일주일에 한번 피하 티르제파타이드 투약한 결과 52주째에 섬유증 악화 없이 MASH 관해율은 최대 62%, MASH의 악화 없이 하나 이상의 섬유화 단계가 개선된 비율은 최대 55%였다.
3상 진입을 예고한 주요 신약후보물질들이 강력한 효과를 내세운 까닭에 레스메티롬이 상용화된다고 해도 경쟁력 측면에서 비교 우위를 점하기 어렵다는 것.
이외에도 현재 개발되고 있는 후보물질이 라니피브라노, 세마글루타이드 등 기전부터 작용 범위까지 다양할 뿐 아니라 터제파타이드는 상용화 이후 MASH로의 적응증 확대를 노리는 '검증된 약제'라는 점도 부담이다.
마드리갈 파마슈티컬스가 책정한 레스메티롬의 연간 치료비용은 6500만원(4만 7400달러)인 것으로 알려졌다.
A대학병원 교수는 "MASH 관해율 30% 달성이라는 레스메티롬 3상을 다르게 해석하자면 치료받은 70% 이상의 환자가 MASH 관해에서 효과를 보지 못했다는 것"이라며 "이런 근거를 가지고 연간 6000만원을 치료비를 환자에게 어떻게 납득시킬 수 있는지가 관건"이라고 말했다.
마운자로로 계산한 터제타파이드의 한달 투약 비용(주 1회)은 미국 기준 약 130만원 선. 비용-효과성 측면이 레스메티롬에겐 성공적인 상용화를 위해 풀어야 할 과제라는 뜻이다.
실제로 이같은 상황은 치매 신약 아두헬름 승인 과정 및 승인 이후 상업화 실패 과정에서 나타난 바 있다.
FDA는 효과성 논란에도 불구하고 '적절한 치료제가 없다'는 현실을 반영해 아두헬름을 승인했지만, 연간 6000만원 대의 치료비 및 레카네맙, 도나네맙과 같은 후발주자들의 상대적인 임상 효과 우위에 따라 상업화를 포기했다.








