다국적 제약업계, 정부 심평원 논의 1개월 방침 관심 집중
학회 의견 및 제약사 자료제출 과정 포함? 100일 기간 주목
보건복지부가 발표한 희귀질환 치료제 신속 등재를 두고 다국적 제약업계의 관심이 계속되고 있다.
급여기준 설정과 약가협상을 2개월 만에 할 수 있느냐 여부에 관심이 쏠리고 있는 것.
7일 제약업계에 따르면, 최근 정부는 관계부처 합동으로 '희귀‧중증난치질환 지원 강화방안'을 발표하며 희귀질환 치료제 신속 등재 제도화 방침을 발표했다.
사실상 지난해 말 보건복지부가 발표한 약가제도 개편안에 포함된 내용을 다시금 확정‧발표했다고 볼 수 있다.
참고로 현재 정부는 허가-평가-협상 절차를 병행하는 시범사업을 2023년 10월부터 운영, 330일이었던 기간을 180일 단축시켜 150일 내에 신 등재하는 제도를 운영하고 있다.
이를 통해 소아 희귀질환 치료제인 '콰지바(디누툭시맙, 레코르다티코리아)'와 가족성 간내 담즙 정체증(Progressive Familial Intrahepatic Cholestasis, 이하 PFIC) 치료제 '빌베이(오데빅시바트, 입센코리아)' 등 2품목을 1호 대상약제로 선정되며 등재된 바 있다.
여기에 2호 약제로 폐동맥고혈압 치료제 윈레브에어(소타터셉트, 한국MSD), 드라벳증후군 치료제 '핀테플라(펜플루라민, 한국UCB제약)', 거대B세포림프종 치료제 '림카토(안발셀, 큐로셀)'이 선정돼 현재 논의를 벌이고 있다.
복지부는 이를 바탕으로 올해부터는 급여 적정성평가 및 협상을 간소화해 희귀질환 치료제의 신속 등재 기간을 100일로 앞당기겠다고 발표했다.
기존 240일로 여겨져 왔던 건강보험심사평가원 약제급여평가위원회 및 국민건강보험공단 약가협상 기간을 2개월 단축시키겠다는 뜻이다.
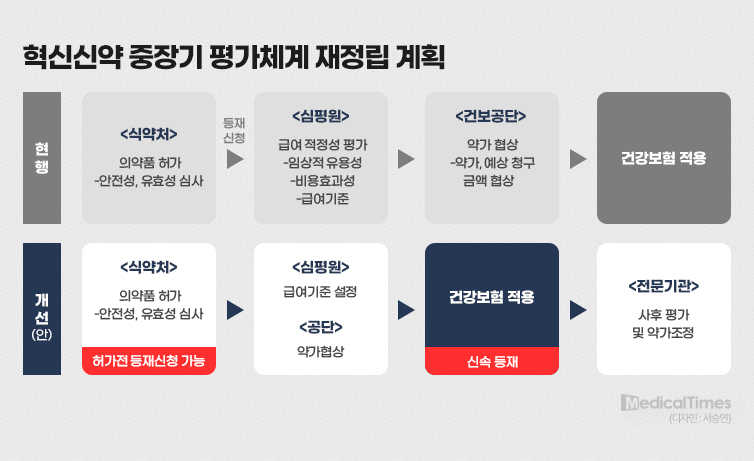
개별적으로 보면 심평원이 맡은 급여기준 설정 업무를 최대 150일에서 1개월로, 건보공단이 맡은 약가협상을 60일에서 1개월로 줄이겠다는 뜻이다. 이 후 최종 의결 기구인 건강보험정책심의위원회 기간은 1개월로 기존과 큰 차이가 없다.
사실상 심평원과 건보공단에서 하는 업무를 단축시키겠다는 의도로 해석된다.
정부의 발표대로 라면 올해 상반기 내 이를 현실화될 것으로 기대되는데, 현재 논의 중인 윈레브에어 등 신속등재 약제에도 영향을 미칠 것으로 보인다.
이를 두고 제약업계에서는 과연 현실화시킬 수 있느냐에 주목하고 있다. 급여기준 설정 과정의 경우 주요 학회 의견과 자료 미비 시 제약사의 자료 제출 등 일련의 과정이 이뤄지게 되는데 이를 1개월로 단축하는 것이 현실적으로 가능한지에 의문을 제기하는 것이다.
건보공단이 맡고 있는 약가협상도 마찬가지.
현재도 신약 등재 및 급여확대를 신청한 품목 논의가 지체되고 있는 상황에서 심평원 및 건보공단의 추가적인 인력확충이 없이는 불가능할 것이라는 의견이 지배적이다.
익명을 요구한 한 제약업계 관계자는 "현재 급여 등재와 적응증 확대 신청을 추진 중인 항암신약 및 병용 치료옵션만 따졌을 때 예상되는 예산 투입액만 수천억원 이상이 될 것이라는 의견이 많다"며 "그 만큼 치료제 급여 논의가 지체되고 있다는 뜻이다. 현재 상황에서 희귀질환 치료제의 급여기준 설정 논의를 1개월로 단축시킬 수 있을지 의문"이라고 꼬집었다.
그는 "급여기준 설정 논의 시 학회 의견 요청 및 자료 미비 시 제약사에가 추가 자료 요청을 해야 한다. 그렇다면 과연 이 기간은 논의 과정에서 제외할 것인가"라며 "단순하게 1개월로 줄이겠다는 것은 어떤 계산에서 나온 것인지 모르겠다"고 지적했다.








