연세대 의학공학, 산부인과교실 연구팀 비임상 성과
난소암 치료제를 암세포까지 옮기는 나노입자 개발

현재 난소암을 조기에 발견할 수 있는 검사는 없다. 이로 인해 대부분 환자가 난소암을 말기에 발견하는데 말기 난소암의 5년 생존율은 30% 정도로 치료 성적이 좋지 않다.
그동안 난소암의 경우 종양을 수술로 제거하고 남은 종양에 대해서 약물치료를 진행했다. 약물 치료제 종류가 제한돼있는 가운데 환자마다 약물치료 반응이 달라 치료 효과가 떨어지는 실정이다. 약물 치료제 또한 정상세포와 암세포를 동시에 파괴하는 문제가 있었다.
성학준·김성훈·이정윤 교수 연구팀은 암세포만 파괴하도록 치료제를 수송하는 물질인 암세포 유래 '나노베지클'을 만들었다. 나노베지클의 성능을 테스트하기 위해 실제 인체와 같은 인공 환경을 조성한 후, 난소암 조직에서 추출한 난소암을 배양해 난소암 칩을 개발했다. 난소암 칩을 마우스 모델에 적용해 실제 효과를 확인하기 위한 실험을 진행했다.
먼저 연구팀은 난소암세포를 필터링을 통해 압출해 나노베지클을 생산했다. 난소암세포 유래 나노베지클은 세포와 세포 간 단백질·리보핵산(RNA)을 운반하는 드론과 같은 역할을 하는 엑소좀 모방체다. 나노베지클을 활용하면 난소암세포를 표적으로 치료제의 정밀한 운반이 가능하다. 나노베지클이 암세포 표면의 단백질 정보를 그대로 저장하고 있기 때문이다.
이와 함께 연구팀은 나노베지클의 성능을 시험하기 위해 실제 난소암이 발생한 환경을 재현했다. 3차원 바이오 프린팅 기술로 틀을 만들고 고분자 섬유를 용해시켜 실제 혈액이 흐르는 것과 같은 환경을 구현했다. 연구팀은 이를 '3차원 미세혈관 네트워크'라고 이름 붙였다. 3차원 미세혈관 네트워크에서는 세포와 같은 생체 물질을 배양할 수 있고 연구 목적에 따라 혈액량 등을 조절할 수 있다.
이어 연구팀은 3차원 미세혈관 네트워크에 실제 난소암 조직을 배양해 동물 또는 인체 이식 가능한 난소암 칩을 개발했다. 난소암 칩의 치료제에 대한 반응이 실제 난소암의 반응과 같은지를 확인하기 위해 환자와 동일한 약물을 투입해 결과를 관찰한 결과, 배양한 난소암 조직 반응이 환자 예후와 일치하는 것을 발견했다.
3차원 미세혈관 네트워크를 통해 나노베지클의 효능을 확인하는 과정도 거쳤다. 정상 조직과 난소암 조직을 3차원 미세혈관 네트워크에 배양한 후 난소암 치료제를 탑재한 나노베지클을 투입했다. 나노베지클은 정상 조직에는 반응하지 않았지만 난소암 조직에서만 반응했을 뿐만 아니라 치료제를 단독으로 투입했을 때보다 조직에서 암세포 수를 줄이는 치료 효과가 1.4배 좋았다.
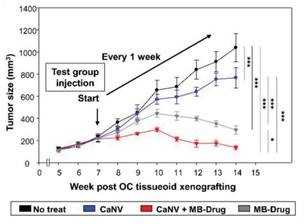
나노베지클의 효과는 마우스 모델에서 교차 검증됐다. 연구팀은 개발한 난소암 칩을 마우스에 이식해 치료제 단독 투여 결과와 치료제를 실은 나노베지클 투여 결과를 비교했다. 그 결과, 나노베지클을 투여했을 시에 암세포 크기를 줄이는 효과가 1.8배 향상됐다.
성학준 교수는 "이번에 만든 난소암 칩은 치료제의 효과를 지속적으로 모니터링하기에 최적화된 시스템"이라며 "난소암 칩과 더불어 개발한 나노베지클은 치료제의 표적 치료를 가능하게 해 치료 효과를 제고하는데 큰 도움이 될 것"이라고 말했다.