한미약품, 신개념 비만치료제 11월 미국비만학회서 첫 공개
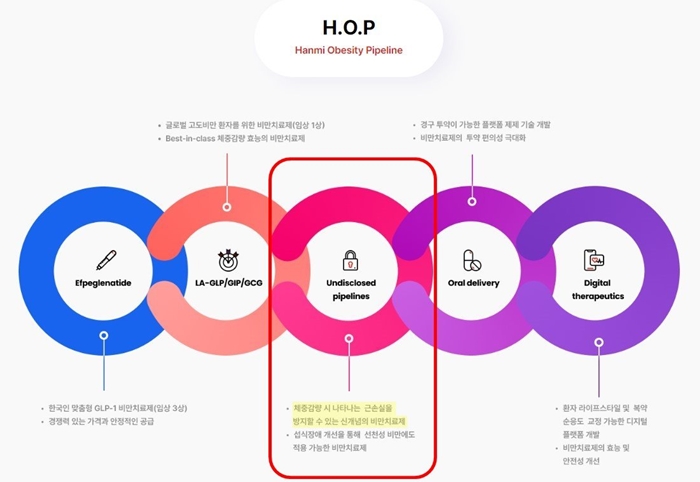
메디칼타임즈=허성규 기자한미약품은 오는 11월 미국비만학회(ObesityWeek)에서 현재 비공개 파이프라인으로 개발 중인 차세대 비만치료제의 비임상 연구 결과가 처음으로 공개될 예정이라고 9일 밝혔다.한미약품이 지난해부터 가동한 'H.O.P' 프로젝트의 차세대 비만치료제의 비임상 연구결과가 오는 11월 처음 공개될 예정이다.해당 후보물질은 한미약품이 지난해 9월 본격 가동하기 시작한 'H.O.P(Hanmi Obesity Pipeline)' 프로젝트 내 과제 중 하나다.이는 체중 감량 시 근육 손실(감량 체중의 최대 40%)을 동반하는 기존 치료제들의 한계를 극복하는 해당 물질은 인크레틴과는 전혀 다른 작용 기전으로 체중 감량 시 근육을 증가시키는 '신개념 비만치료제'로 디자인됐다.해당 비공개 파이프라인의 경우 인크레틴 병용은 물론 단독요법으로도 체중감량의 질을 획기적으로 개선할 수 있을 것으로 기대하고 있다.이와 함께 한미약품은 H.O.P(Hanmi Obesity Pipeline) 프로젝트를 통해 경구용 비만치료제, 비만 예방 및 관리에 적용할 수 있는 디지털치료제 등 비만 환자의 라이프스타일 및 복약 순응도 교정이 가능한 제품 개발에도 매진하고 있다.한미약품 관계자는 "비만 신약 출시 시점 뿐만 아니라 비만 및 대사질환 치료제 개발에 대한 연구나 노하우 측면에서 국내 제약·바이오 기업 중 가장 앞서 있는 기업이 한미약품이기에, 그만큼 시장의 기대가 큰 것으로 안다"며 "한국 제약회사가 처음부터 끝까지 독자 기술로 개발하는 최초의 비만 신약 탄생이 신속하고 성공적으로 이뤄질 수 있도록 최선을 다하겠다"고 말했다.한미약품 최인영 R&D센터장은 "올해 하반기는 그간의 연구성과들을 글로벌 무대에서 선보이는 중요한 시점"이라며 "특히 미국비만학회에서 처음 공개될 신개념 비만치료제 후보물질은 단독요법으로도 비만 치료의 새로운 패러다임을 제시할 뿐만 아니라, 기존 치료제와의 병용이 가능하도록 설계돼 H.O.P.의 글로벌 경쟁력을 증명할 수 있는 게임체인저가 될 것"이라고 전했다.