조병철 교수 국산신약 위상 높아질 것...계속 도전해야
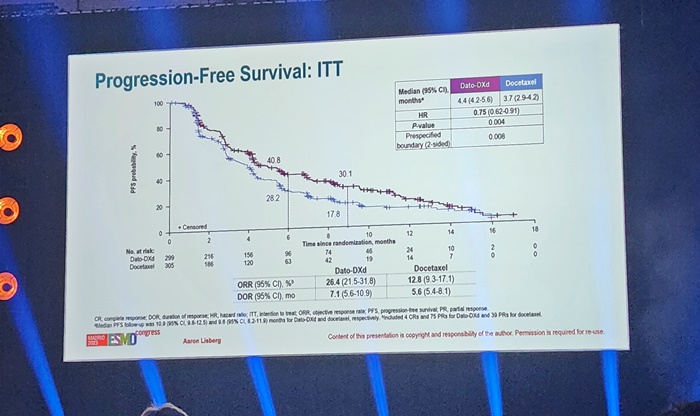
메디칼타임즈=박상준 기자유럽종양학회에서 조병철 교수(신촌세브란스 연세암병원 폐암센터)를 만나 렉라자 개발과 미국허가까지의 서사를 소개하고 있다.조병철 교수(신촌세브란스 연세암병원 폐암센터)가 렉라자를 글로벌 신약 반열에 올려놓을 수 있었던 것은 꾸준한 연구끝에 찾아온 우연한 기회를 잘 잡았기 때문이라고 평가했다. 그러면서 기회를 놓치지 않고 끈기있기 밀어부쳐 미국 FDA 허가까지 갈 수 있었다고 소회했다. 14일 유럽종양학회(ESMO)에서 만난 조 교수는 “렉라자를 개발하는 매순간이 힘들었고 위기도 많았다”며 ”주변에서 어떻게 볼지 모르겠지만 개인적으로는 운이 정말 좋았던 것 같고, 운을 주변과 함께 나누면서 이 자리까지 올 수 있었다“고 소감을 밝혔다. 렉라자는 국산 최초의 글로벌 항암제로 물질 탐색부터 미국FDA 허가에 이르기 총 10년이 걸렸다. 대표 연구인 MARIPOSA는 렉라자 연구의 랜드마크로 평가받으며, 동시에 전 세계 최고의 인용지수를 자랑하는 뉴잉글랜드저널오브메디신(NEJM)에 실리는 쾌거도 이뤄냈다. 현재 국내에서는 렉라자 단독 치료요법으로서 EGFR 비소세포폐암 1차 2차 치료제로 사용할 수 있고, 미국에서는 레이저티닙과 아미반타맙 병용요법으로 1차 치료제로 허가를 받으면서 경쟁약인 오시머니팁과 어깨를 나란히 하고 있다. 게다가 최근 미국암네트워크(NCCN) 가이드라인에도 추가됐으며, 이를 계기로 연일 해외학회 연구자들에게 주목받으며 본격적인 신약 반열에 올라섰다는 평가다. 조 교수가 렉라자 개발 과정을 운이라고 표현한 것은 우연히 거의 같은 시기에 두 약제의 연구가 시작됐고, 또 두 약제가 동시에 EGFR 돌연변이 비소세포폐암 환자에게 작용한다는 사실을 찾아내면서 연구가 급물살을 탔기 때문이다. 여기에 더해 동시개발이라는 환경이 해외 기술이전까지 이어질 수 있었다고 평가했다. 조 교수는 "렉라자와 아미반타맙이라는 두 약제를 연구하는 과정에서 글로벌 제약사들에게 설명하는 기회가 엄청나게 많았고, 결과적으로 이러한 과정이 렉라자를 글로벌 제약사인 얀센에 기술이전 할 수 있는 토대가 된 것 같다“고 말했다.그는 "거의 같은 시기에 두 개의 약물을 접하면서 기초임상부터 임상3상 연구까지 진행했다. 이런 기회가 또 생길 확률은 극히 드물지 않겠느냐. 돌이켜보면 정말 기적 같은 일"이라고 말했다. 조병철 교수 그러면서 안주하지 않고 신약개발을 현실화시키기 위해 많은 연구자들이 땀을 흘리며 개발한 것이 최종적으로 미국 FDA 승인이라는 또한번의 기적을 만들어낸 것이라고 설명했다. 우연이 계속되고 있다는 그는 에피소드도 소개했다. 유한양행과 얀센이 비밀리에 기술수출 라이센스 제휴를 맺는 장소가 하와이 모처였는데, 때마침 하와이에서 가족여행을 하는 그날 그 장소에 있었다는 것. 매순간순간이 운명적 만남이라고 했다. 그는 이러한 운명적 기회도 계속 시도하고 도전하는 사람에게 찾아온다면서 신약개발을 시도하고 있는 바이오텍과 제약사들를 위한 당부의 말도 잊지 않았다.우선 협력을 강조했다. 수많은 후보 약제들 중 가능성을 찾았다면 신약개발자, 중개연구자, 임상연구자 등의 유기적인 협력 시스템을 만들어 접근하는 전략이 필요하다고 강조했다. 이어 성과를 만들어 글로벌 연구자들의 관심 대상이 될 수 있도록 끊임없이 어필해야하고 한다고 조언했다. 또한 제약사들은 실패를 두려워하지 않고 끊임없이 도전해야 하고 빠른 의사결정 과정이 필요하다고 강조했다. 그래야만 연구자들이 개발의지가 꺽이지 않고 도전할 수 있다고 못박았다. 그는 교과서적인 이야기로 들리겠지만 유한양행도 연구자들을 믿었고, 투자측면에서도 통크게 밀어줬기 때문에 가능했다. 당시 의사결정자였던 이정희 의장에게 감사하다고 말했다.앞으로 렉자라 미국 허가를 계기로 한국의 신약의 위상증가를 전망했다. 조 교수는 "유수의 국제학회에서 연구자들과 이야기해보면 렉라자로 통한다"며 "이는 한국신약이 미 FDA 등재를 계기로 위상이 높아졌음을 대변한다"면서 "덩달아 한국 연구자들의 위상도 점점 더 높아질 것이며 연구기회와 협력도 그만큼 더 많아질 것이다. 당장 신약개발에 고삐를 늦추지 말아야 한다"고 당부했다.