로그인
 로그인을 하시면 메디칼타임즈의
로그인을 하시면 메디칼타임즈의다양한 연관서비스를 이용하실 수 있습니다. 가입 시 등록한 정보를 입력해주세요.
 개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.
개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.안전한 개인정보 보호를 위해 3개월마다 비밀번호를 변경해주세요. ※ 비밀번호는 마이페이지에서도 변경 가능합니다.
30일간 보이지 않기
- 제약·바이오
- 국내사
"공동개발 늘고 특허만료 줄고" 생동시험 가뭄
발행날짜: 2018-02-21 11:39:25
-
가
-
4년간 생동성시험 35% ↓ 대사·순환·CNS 절반 차지
제약사간 공동개발과 특허 만료 품목 감소의 영향으로 허가목적 생동계획서 승인 건수 4년간 34.9% 감소한 것으로 나타났다.
한편 대사성, 순환계, 중추신경계의약품 개발은 매년 꾸준히 이뤄져, 전체 승인건수의 절반 이상(55.6%)을 차지했다.
21일 식품의약품안전처 식품의약품안전평가원의 제네릭의약품 개발동향 분석에 따르면 2017년 제네릭의약품 허가를 위해 승인받은 생물학적동등성계획 승인건수가 106건으로 전년(123건) 대비 약 13.8% 감소했다.
허가목적 생동계획서 승인 건수는 2013년 163건에서 2014년 156건, 2015년 201건, 2016년 123건, 2017년 106건으로 4년간 34.9% 감소했다.
생동성시험계획 승인 건수는 지난 2011년 이후 제약사가 공동으로 생동성시험을 진행하거나 수익성이 높은 제품의 공동개발하면서 감소했고, 특히 지난해 승인건수 감소는 2018년 만료되는 재심사 및 특허 대상 품목이 감소한데 따른 것으로 분석된다.
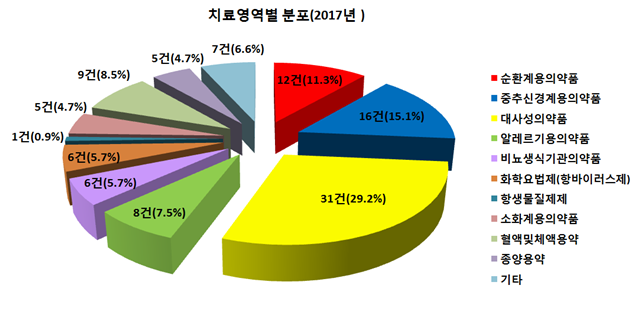
지난해 승인된 생동성시험의 주요 특징은 ▲재심사, 특허만료 의약품 개발 집중 ▲치료영역별로 대사성의약품, 중추신경계용의약품, 순환계의약품 개발 추세 지속 등이다.
작년 승인된 생동계획서 중 재심사나 특허 만료 예정 품목에 대한 비중은 56건(53%)으로 절반을 차지했다.
재심사·특허 만료 예정 의약품 관련 생동성시험 승인 비율은 2015년 74%, 2016년 68%, 2017년 53%다.
이 가운데 생산실적이 높고 지난해 11월 재심사가 만료된 당뇨병성 다발성 신경염 치료제 덱시드정(알티옥트산트로메타민염) 제품(13건) 개발이 가장 많았다. 덱시드정의 2017년 1~3분기 생산실적은 108.6억원을 기록했다.
그 뒤를 이어 당뇨병치료제 리나글립틴, 메트포르민염산염(5건), 고혈압치료제 암로디핀베실산염, 올메사르탄메독소밀, 히드로클로로티아지드(5건) 개발이 많았다.
치료영역별로는 노인 인구 증가로 인한 당뇨병치료제 등 대사성의약품(31건, 29.2%), 치매 등에 사용하는 중추신경계용의약품(16건, 15.1%), 고혈압치료제 등 순환계용의약품(12건, 11.3%) 순으로 개발이 활발하게 이뤄지는 것으로 나타났다.
대사성, 순환계, 중추신경계의약품 개발은 매년 꾸준히 이뤄지고 있으며, 전체 승인건수의 절반 이상(55.6%)을 차지했다.
대사성의약품 승인건수가 가장 많은 것은 당뇨병성 다발성 신경염 치료제 '알티옥트산트로메타민염'(13건) 개발이 증가하고, 2016년에 이어 당뇨병치료제 '리나글립틴'(6건, 복합제 포함) 개발이 지속적으로 이뤄진데 따른 것이다.
한편 대사성, 순환계, 중추신경계의약품 개발은 매년 꾸준히 이뤄져, 전체 승인건수의 절반 이상(55.6%)을 차지했다.
21일 식품의약품안전처 식품의약품안전평가원의 제네릭의약품 개발동향 분석에 따르면 2017년 제네릭의약품 허가를 위해 승인받은 생물학적동등성계획 승인건수가 106건으로 전년(123건) 대비 약 13.8% 감소했다.
허가목적 생동계획서 승인 건수는 2013년 163건에서 2014년 156건, 2015년 201건, 2016년 123건, 2017년 106건으로 4년간 34.9% 감소했다.
생동성시험계획 승인 건수는 지난 2011년 이후 제약사가 공동으로 생동성시험을 진행하거나 수익성이 높은 제품의 공동개발하면서 감소했고, 특히 지난해 승인건수 감소는 2018년 만료되는 재심사 및 특허 대상 품목이 감소한데 따른 것으로 분석된다.

작년 승인된 생동계획서 중 재심사나 특허 만료 예정 품목에 대한 비중은 56건(53%)으로 절반을 차지했다.
재심사·특허 만료 예정 의약품 관련 생동성시험 승인 비율은 2015년 74%, 2016년 68%, 2017년 53%다.
이 가운데 생산실적이 높고 지난해 11월 재심사가 만료된 당뇨병성 다발성 신경염 치료제 덱시드정(알티옥트산트로메타민염) 제품(13건) 개발이 가장 많았다. 덱시드정의 2017년 1~3분기 생산실적은 108.6억원을 기록했다.
그 뒤를 이어 당뇨병치료제 리나글립틴, 메트포르민염산염(5건), 고혈압치료제 암로디핀베실산염, 올메사르탄메독소밀, 히드로클로로티아지드(5건) 개발이 많았다.
치료영역별로는 노인 인구 증가로 인한 당뇨병치료제 등 대사성의약품(31건, 29.2%), 치매 등에 사용하는 중추신경계용의약품(16건, 15.1%), 고혈압치료제 등 순환계용의약품(12건, 11.3%) 순으로 개발이 활발하게 이뤄지는 것으로 나타났다.
대사성, 순환계, 중추신경계의약품 개발은 매년 꾸준히 이뤄지고 있으며, 전체 승인건수의 절반 이상(55.6%)을 차지했다.
대사성의약품 승인건수가 가장 많은 것은 당뇨병성 다발성 신경염 치료제 '알티옥트산트로메타민염'(13건) 개발이 증가하고, 2016년에 이어 당뇨병치료제 '리나글립틴'(6건, 복합제 포함) 개발이 지속적으로 이뤄진데 따른 것이다.

관련기사
- 신경병증 시장 촉매제 될까…덱시드 제네릭 출격 2018-01-31 05:00:45
- 상반기 제네릭 생동승인 활발…전년 대비 49% ↑ 2017-08-30 11:55:52
제약·바이오 기사
- 한국콜마 CJ헬스케어 인수 확정…약될까 독될까 2018-02-21 05:33:55
- 매출액 덩치 키운 국내 제약사…실적 체력 '비실' 2018-02-21 05:00:57
- 업그레이드 표방 건선약 경쟁 '게임체인저' 될까 2018-02-21 05:00:53
- 보습력·손상 개선·비타민까지…점안제 경쟁 눈길 2018-02-20 11:56:24
- 릴리, 한미 도입 류마티스관절염 임상 중단 왜? 2018-02-20 10:53:13
제약·바이오 기사
많이 읽은 뉴스
이메일 무단수집 거부
메디칼타임즈 홈페이지에 게시된 이메일 주소가 전자우편 수집 프로그램이나
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.









/NewsMain.jpg)












/NewsMain.jpg)

/NewsMain.jpg)
- 최신순
- 추천순
댓글운영규칙ex) medi****** 아이디 앞 네자리 표기 이외 * 처리
댓글 삭제기준 다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입이 제한될 수 있습니다.
1. 저작권・인격권 등 타인의 권리를 침해하는 경우
2. 상용프로그램의 등록과 게재, 배포를 안내하는 게시물
3. 타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
4. 욕설 및 비방, 음란성 댓글