국내 첫 SGLT-2i 신약 엔블로정 활용 방안 확대 움직임
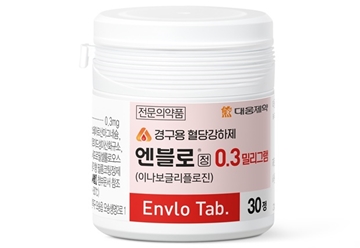
메디칼타임즈=허성규 기자국내 첫 SGLT-2 억제제 계열 당뇨병 신약 엔블로정을 둘러싼 연구자 임상에 속도가 붙고 있다.대웅제약이 자체적으로 적응증 확대에 노력하고 있는 가운데 연구자 임상도 확대되고 있다는 점에서 과연 어느 영역에서 새로운 활로가 열릴지 주목된다.대웅제약의 엔블로정 제품사진.3일 식품의약품안전처에 따르면 세브란스병원은 엔블로정에 대한 연구자 임상을 승인 받았다.이 임상은 전극도자 절제술을 받는 심부전을 동반한 심방세동 환자에서 이나보글리플로진(엔블로정)의 심방세동 재발에 대한 예방적 효과를 평가하기 위한 임상이다.이번 엔블로정의 연구자 임상이 주목되는 것은 이와 관련한 제약사의 자체적인 임상에 더해 연구자 임상 역시 지속적으로 확대되고 있기 때문이다.대웅제약의 엔블로정은 지난 2022년 11월 국산 36호 신약으로 허가를 받아 2023년 5월 출시됐다.특히 엔블로정은 국내에서 SGLT-2 억제제 계열로는 처음 허가 받은 국산 신약으로 관심이 높았고, 회사 역시 이에 대한 적응증 확대 등 성장에 박차를 가하고 있는 상황이다.대웅제약은 엔블로정 출시 이후 메트포르민 복합제 엔블로멧을 출시했고 현재 제미글로 복합제 개발을 위한 생동시험을 추진 중이다.여기에 적응증에 있어서도 중등증 만성신장질환 환자 대상 추가 임상을 신청하며, 치료 약물의 선택 옵션 확대를 위한 노력을 이어가고 있다.특히 대웅제약은 지난 5월 출시 1년을 맞아서 기념 행사인 ‘엔블로드 위크'를 진행, 추가 임상 등을 발표한 바 있다.해당 심포지엄에서는 ▲엔블로 52주 연장연구 ▲엔블로-다파글리플로진 스위칭 연구 ▲경증신기능장애 동반 2형 당뇨병 환자 대상 혈당강하 효과와 장기 복용안전성 등의 연구결과 등이 공유 됐다.즉 이같은 회사 차원의 노력을 넘어 연구자임상에서도 엔블로정에 대한 관심이 높아지는 상황.실제로 엔블로정과 관련한 연구자임상이 꾸준히 추가되는 상황으로 지난해에는 기능성 삼첨판 역류를 동반한 박출률 보존 심부전 환자에서 이나보글리플로진의 치료 효과에 대한 연구와 지난해에는 경피적 대동맥판막 교환술 시행한 중증 대동맥판막 협착 환자에서 임상경과에 대한 효능 비교 연구 등 2건의 연구자 임상이 승인됐다.이어 올해에도 현재까지 총 4건의 연구자 임상이 승인 된 상태로, 지난 1월에는 신장이식 수혜자에서 신장 질환 진행 시 표준 치료에 추가한 엔블로정의 유효성·안전성을 평가하기 위한 임상선행연구가 승인됐다.이어 3월에는 비폐쇄성 비후성 심근병증 환자에서 이나보글리플로진이 이완기 기능 장애에 미치는 영향에 대한 연구와 박출률 보존 심부전 (HFpEF)에서 운동 수행능력과 이완 기능에 대한 이나보글리플로진의 효능 연구자 임상이 승인됐다.이처럼 추가적인 임상이 꾸준히 진행되는 것은 당뇨병 신약으로 유효성·안전성이 입증, 추가적인 활용이 가능하다는 판단 때문인 것으로 풀이된다.이에따라 대웅제약이 최근 1품 1조라는 목표하에 엔블로에 대한 공을 들이는 만큼 추가적인 적응증 확대 등 변화가 이어질 수 있을지 역시 관심이 주목된다.