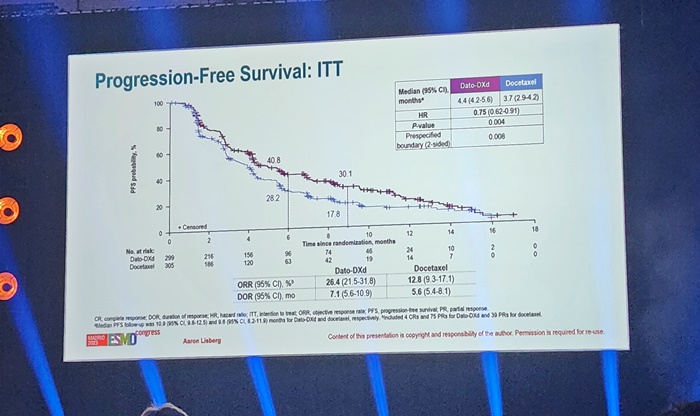
"올해 마지막 기회 잡아라" 10월 암질심 향하는 신약들
메디칼타임즈=문성호 기자다가오는 10월 건강보험심사평가원 암질환심의위원회에 다국적 제약업계의 관심이 집중되고 있다.임상 현장에서 영향력을 확대하고 있는 주요 치료제들의 급여기준 설정 논의가 예고돼 있다는 점에서 초미의 관심이 모아지고 있는 것. 심평원은 오는 10월 2일 제7차 암질환심의위원회를 개최할 예정이다. 주요 제약사들이 해당 회의에 자사 치료제를 상정시키기 위해 노력 중이다.13일 제약업계에 따르면, 심평원은 오는 10월 2일 제7차 암질환심의위원회(이하 암질심)을 개최할 예정이다.이 가운데 이달 암질심이 개최되지 않으면서 다가오는 10월 암질심에 상정될 치료제에 관심이 쏠리고 있다.우선 지난해 담도암 1차 치료 급여 확대에 실패한 임핀지(더발루맙, 아스트라제네카)가 암질심 재도전에 나설 전망이다. 지난해의 경우 짝을 이루는 '젬시스(젬시타빈+시스플라틴)'만 급여로 적용받으면서 아스트라제네카가 다양한 근거를 추가해 암질심에 급여를 재신청한 방 상태다.그 사이 담도암 시장에 MSD 키트루다(펨브롤리주맙)가 국내 적응증을 확보, 임상현장에서의 경쟁에 돌입하면서 임핀지 입장에서 선제적인 급여 적용 필요성이 더 커진 상황이다. 여기에 GSK의 면역항암제 젬퍼리(도스탈리맙)도 자궁내막암 급여 확대를 추진 중인 것으로 알려지면서 관심을 받고 있다. 잼퍼리는 PD-1을 표적으로 하는 단일클론항체로, T세포 표면의 PD-1 수용체와 결합해 암세포의 PD-1 또는 PD-L2 사이에 결합을 방해함으로써 항종양 면역을 활성화한다.지난해 8월 건강보험심사평가원이 젬퍼리가 '재발성 또는 진행성 불일치 복구결함(dMMR)/고빈도 현미부수체 불안정(MSI-H) 자궁내막암'에 급여 적정성이 있다고 결론지은 후 보건복지부가 12월부터 급여로 적용된 바 있다.이는 지난해 12월 식약처가 허가 한 후 1년 만에 2차 치료제로 급여로 적용되는 셈인데, 현재 회사 측이 1차 치료제로 급여 확대를 추진 중인 것으로 알려진 상황이다.그만큼 임상현장에서의 필요성이 크다는 뜻인데, 암질심에 상정된다면 국내 허가 2년 만에 1차 치료 급여확대에 도전하게 되는 셈이다.아울러 제약사뿐 아니라 환자단체도 일부 특정 질환 치료제의 빠른 암질심 상정을 촉구하고 있다.최근 한국백혈병환우회는 한국로슈의 B세포 림프종 치료제인 컬럼비(글로피타맙)의 10월 암질심 상정을 요구하고 있다. 컬럼비는 B세포 림프종 치료를 위한 최초의 이중특이항체다.악성 B세포 표면에 발현하는 CD20 영역 2개와 면역세포 T세포 표면에 발현하는 CD3 영역 1개를 결합하는 2:1 구조의 CD20xCD3 T세포 관여 이중특히항체로, 면역 T세포가 악성 B세포를 타깃하도록 설계됐다.두 가지 이상의 전신치료 후 재발성 또는 불응성 미만성 거대 B세포 림프종(이하 DLBCL) 성인 환자의 치료제로 허가를 받았는데, 지난 7월 암질심에서는 급여기준 설정에 실패한 바 있다.백혈병환우회는 "컬럼비는 CAR-T 치료제인 킴리아(티사젠렉류셀)와 같이 미만성 거대 B세포 림프종 3차 치료제다. 두 약제는 각기 서로 다른 장단점을 갖고 있어서 환자와 의료진 입장에서는 약제 선택권을 크게 개선했다"며 "컬럼비는 현재 다수의 상급종합병원에서 비급여 처방이 가능한 상황이며, 모든 치료에 실패한 미만성 거대 B세포 림프종 환자들은 신속한 건강보험 등재를 간절히 기다리고 있다"고 전했다.이어 "10월 개최 예정인 암질심에서 컬럼비의 재상정과 통과를 촉구한다"며 "한국로슈 컬럼비 치료가 시급한 환자를 대상으로 고액의 비급여 약제비 부담 완화를 위해 환자지원 방안을 모색해야 한다"고 촉구했다.