차곡차곡 근거 쌓이는 ‘렉라자’ 조합...희귀 돌연변이도 잡는다
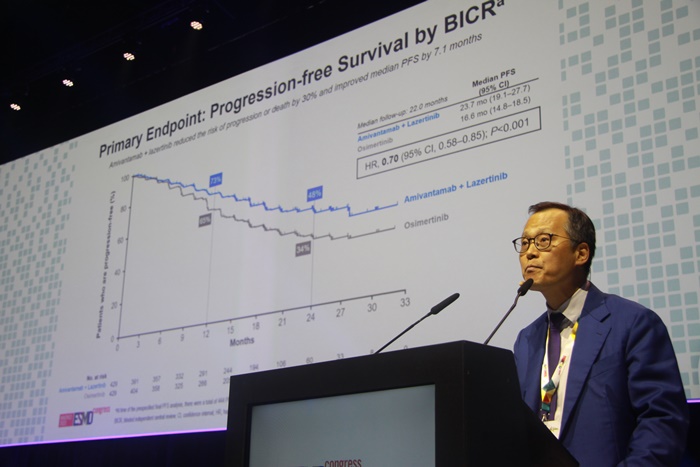
메디칼타임즈=박상준 기자세브란스병원 조병철 교수가 1일 CHRYSALIS-2 1상 연구 결과를 통해 레이저티닙과 아미반타납의 새로운 가능성에 대해 발표했다. 레이저티닙과 아미반타맙 병용요법(일명 레아미)이 고위험군 환자에 이어 비정형(희귀) EGFR 돌연변이를 가진 비소세포폐암 환자에게 최적의 대안이 될 수 있다는 근거가 나왔다. 1일 미국임상종양학회(ASCO)에서 공개된 CHRYSALIS-2 1상 연구에 따르면, 비정형 EGFR 돌연변이 비소세포폐암 환자에게 레이저티닙과 아미반타맙 병용요법을 1차로 투여할 경우 객관적 반응률(ORR)을 57%까지 끌어내는 동시에 무진행생존기간(mPFS)도 19.5개월까지 늘어나는 것으로 나타났다. 이는 기존 치료법에서 보여준 것보다 두 배 가량 높은 수치로 향후 레이저티닙과 아미반타맙 병용요법이 희귀 EGFR 돌연변이 환자에서 표준으로 자리잡을 수 있다는 점을 시사한 연구이다. 현재 EGFR 돌연변이 환자 중 85~90%는 EXON 19 결손 또는 삽입, Exon 21 L858R 유전자 형태를 보이고, 나머지 5~10%가 G719X, S768I, L861Q 등과 같은 희귀 돌연변이 유전자를 차지한다. 이런 유전자가 있으면 그렇지 않은 환자보다 예후가 월등히 떨어진다. 희귀 유전자를 포함한 모든 환자에서 치료는 통상 아파티닙 또는 오시머티닙으로 하는데, 그 치료성과는 무진행생존기간 기준으로 대략 10개월 수준이다. 하지만 CHRYSALIS-2 연구에서는 이러한 희귀 유전자가 있는 코호트를 떼어내 레이저티닙과 아미반타맙으로 치료를 했고, 그 결과 무진행생존율이 기존 보다 2배 더 증가하는 것을 확인했다. CHRYSALIS-2 연구 프로토콜희귀 EGFR 돌연변이 비소세포폐암 환자군에서 레이저티닙과 아미반타맙의 치료효과.연구를 발표한 연세의대 조병철 교수는 “그동안 비정형 EGFR 돌연변이 폐암 환자에 대한 예후가 낮았지만 새로운 치료법에 대한 근거가 없었다”면서 “이번 결과로 레이저티닙과 아미반타맙이 해당 환자에서 새로운 표준으로 자리잡을 수 있는 치료 스페트럼을 확인했다는 점에서 의미가 있다‘고 말했다. 이어 ”다만 2차 또는 3차로 치료했을 때는 기존의 치료와 유사한 결과가 나타난 만큼 이번 연구는 1차 치료로 썼을 때 의미가 있다“고 강조했다. 한편 MARIPOSA 연구에 이어 CHRYSALIS-2 연구까지 추가되면서 레이저티닙과 아미반타맙의 병용효과의 근거가 꾸준히 쌓이는 모양이다. 앞서 31일 발표된 MARIPOSA 3상 연구에서 순환종양DNA(ctDNA) 확인, TP53 유전자 동반, 간전이 동반과 같은 고위험 환자에게 투여시 오시머티닙 단독보다 높은 효과를 보이는 것으로 나타났다. 여기에 PALOMA-3 연구 통해 입증된 아미반타맙의 피하제형의 효과까지 나오면서 레이저티닙과 아미반타맙 조합은 이제 편리하고 강력한 항암 치료 옵션으로 점차 힘을 얻을 전망이다.