3파전으로 번진 P-CAB 대전…국내 넘어 해외 경쟁 예고
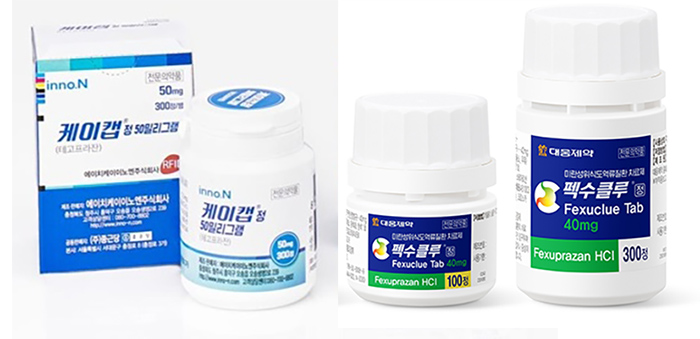
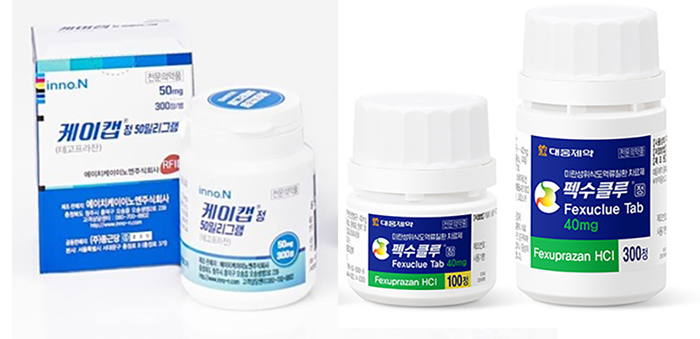
메디칼타임즈=허성규 기자케이캡과 펙스클루 등 국산 P-CAB 제제가 선풍적 인기를 끌면서 이제 국내를 넘어 해외 시장에서 점유율 경쟁에 돌입하는 모습이다. 특히 국내에서는 각 파트너사와의 협력을 통한 경쟁을 지속하고 있는 가운데 중국, 인도 및 중남미 시장 등 해외 진출 역시 유사한 행보를 보이고 있는 것으로 파악됐다.국내 출시 이후 해외 시장을 공략 중인 케이캡, 펙수클루에 이어 3번째 국산 P-CAB 제제인 자큐보 역시 빠르게 기술 수출 성과를 올리며 경쟁에 속도를 내고 있다.12일 온코닉테라퓨틱스는 멕시코의 라보라토리 샌퍼와 위식도 역류질환 치료 신약 '자큐보(자스타프라잔)'의 기술 수출 계약을 체결했다고 밝혔다.이번 기술수출이 주목되는 것은 중국, 인도 등의 아시아권을 넘어 처음으로 중남미 진출에 성공했다는 점이다.또한 이번에 계약을 체결한 라보라토리 샌퍼의 경우 멕시코를 포함해 중남미 지역 총 19개 국가에 자회사와 지사를 보유하고 있으며, 해당 국가까지 계약 대상에 포함했다.즉 한 건의 계약 체결에 따라 중남미 19개국 진출의 가능성이 열리면서 총 21개국 진출이 가시화 된 상황이다.제일약품 관계자는 "현재 해외 진출을 위해서 노력을 이어가고 있는 상황"이라며 "현재도 여러 기업들과 가능성을 타진하고 있다"고 전했다.케이캡 46개국·펙수클루 30개국 진출…중남미 격전지 되나다만 이미 국내 출시 이후 글로벌 시장에 빠르게 뛰어든 '케이캡'과 '펙수클루'도 100개국 진출을 목표로 속도를 내고 있다는 점이 변수다.첫 국산 P-CAB제제로 이름을 올린 HK이노엔의 '케이캡'의 경우 이미 글로벌 45개국에 진출한 상태다.케이캡은 2028년 100개국 이상의 진출을 목표로 중국 기술수출을 시작으로 빠르게 해외 진출에 나섰다.이후 케이캡은 미국·캐나다 기술수출을 비롯해 브라질, 인도, 몽골, 남아프리카공화국, 동남아 6개국, 동유럽 5개국, 중동·북아프리카 10개국, 중남미 17개국 등 한국을 포함해 총 46개국에 진출 한 것.특히 한국을 비롯해 중국, 필리핀, 몽골, 멕시코, 인도네시아, 싱가포르, 페루, 칠레 등에서는 출시까지 마치며 시장에서 입지를 확보하고 있다.그 뒤를 이은 대웅제약의 '펙수클루' 역시 2027년 100개국 진출을 목표로 빠른 해외 진출과 출시를 진행하고 있다.대웅제약은 2021년 브라질을 시작으로 해외 진출을 본격화 했고 현재 한국을 포함해 총 30개국에 진출한 상태다.펙수클루의 경우 현재 한국, 필리핀에 이어 지난 8월 멕시코, 에콰도르, 칠레 3개국에서 동시 출시되며, 총 5개국에서 출시에 성공했다.품목 허가 신청의 경우 콜롬비아, 페루, 브라질, 모로코, 중국, 태국, 베트남, 인도네시아, 말레이시아, 싱가폴, 사우디아라비아 등 11개국에 품목허가 신청이 이뤄진 상태다.이처럼 앞선 기업들 역시 중국, 인도에 이어 성장 가능성이 높은 중남미 시장에 이미 진출해 있다는 점에서 이들 3개사의 경쟁도 치열해질 것으로 보인다.남미의 제약·바이오산업 시장은 2017년에서 2022년 동안 6.6%의 연평균 성장률을 기록했으며, 2022년에서 2027년 동안에는 7.8%로 성장이 가속화될 것으로 예상되는 상황이다.이중 중남미 지역(아르헨티나·브라질·칠레·콜롬비아·에콰도르·멕시코·페루)의 제약시장은 2023년에 19.2%의 성장률을 기록했고, 2022~2027년까지 연평균 22%의 성장률을 달성할 것으로 예상돼 전 세계 주요 시장 중 가장 빠르게 성장하는 지역으로 주목받고 있다.국내 P-CAB 제제 시장을 양분하고 있는 HK이노엔의 '케이캡'과 대웅제약의 '펙수클루' 제품사진 연내 급여 가능성…파트너사와 협력해 시장 경쟁 예고한편 해외 진출 외에도 곧 국내에서도 이들의 경쟁이 본격화 될 것으로 예상된다.업계에 따르면 제일약품 등 3개사가 최근 약평위에서 결정한 평가금액 이하 수용시 급여의 적정성있다는 내용을 수용한 것으로 알려졌기 때문이다.약평위 결정을 수용하게 되면 향후에는 건보공단과의 협상을 통한 급여 등재 마지막 절차만 남게 된다.즉 연내 출시가 가시화 된 만큼 곧 3개사의 P-CAB 제제가 국내 시장에서 경쟁을 본격화 하게 되는 것.특히 국내 P-CAB 제제 시장의 경우 개발사와 파트너사의 협력을 통해 시장에서 입지를 확대하는 만큼 사실상 6개사의 경쟁이 벌어지는 셈이다.현재 온코닉테라퓨틱스가 개발한 자큐보는 모회사인 제일약품이 동아에스티와 함께 판매에 나선다는 계획이다.현재 시장을 양분하고 있는 케이캡과 펙수클루 역시 HK이노엔과 보령, 대웅제약과 종근당의 협력을 통해 시장에서 경쟁하고 있는 만큼 동아에스티와의 시너지를 기대하고 있는 것.특히 위식도역류질환 치료제 시장에서 P-CAB제제가 차지하는 비중이 점차 커지고 있는 만큼 이들 기업간 경쟁은 더욱 치열해질 수 밖에 없다.실제로 유비스트에 따르면, 지난해 기준 P-CAB과 위식도역류질환 치료제 시장의 대표 성분인 PPI 제제의 매출액은 총 9127억원에 달하는 수준으로, 이중 P-CAB제제는 2176억원으로 약 23.8%의 비중을 차지하고 있다.