조병철 교수 렉라자 연구 NEJM 등재 쾌거...항암분야 최초
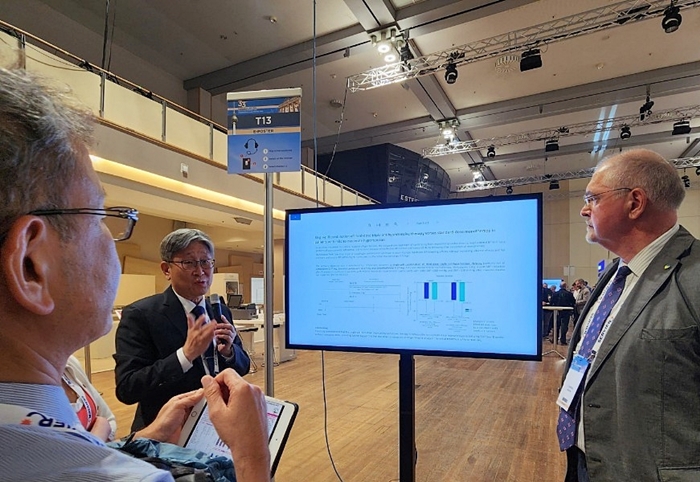
메디칼타임즈=문성호 기자세계 최고 권위의 의학저널인 '뉴잉글랜드 저널 오브 메디신(NEJM)'에 논문을 게재한 또 하나의 한국인 의사가 탄생했다. 주인공은 조병철 연세의대 교수(연세암병원 폐암센터장, 종양내과)다. 렉라자(레이저티닙, 유한양행)와 리브리반트(아미반타맙, 존슨앤드존슨) 병용으로 비소세포폐암 1차 치료 효과를 확인한 'MARIPOSA' 연구 결과가 최근 'Amivantamab plus Lazertinib in Previously Untreated EGFR-Mutated Advanced NSCLC'라는 제목으로 NEJM에 실린 것이다. NEJM은 인용지수가 158점을 육박하는 자타공인 전 세계 최고의 학술지다. 많은 연구자들이 이 논문에 이름을 올리는 것이 목표라고 할 만큼 높은 권위를 자랑한다. 그동안 심장분야(박승정 교수)와 위진단분야(최일주 교수)에 국내 연구자들이 이름을 올린 적은 있지만 항암분야에서 처음이다. 이번 등재를 계기로 국산 신약과 폐암 치료에 대한 관심도 높아질 것으로 보인다.조병철 연세의대 교수는 렉라자+리브리반트 병용요법의 비소세포폐암 1차 치료 효과를 확인한 'MARIPOSA'가 NEJM에 게재된 것에 대한 소감을 밝혔다. 28일 조병철 연세의대 교수에게 직접 항암분야 연구 NEJM 게재의 의미를 들어봤다. 한국인이 만든 국산신약 인정받다이번 NEJM에 게재된 논문은 지난해 유럽임상종양학회 연례학술회의(ESMO Congress 2023)에서 조병철 교수가 직접 발표한 MARIPOSA 연구다. 해당연구는 렉라자(레이저티닙)와 리브리반트(아미반타맙)과의 병용으로 비소세포폐암 1차 치료에서 표준치료로 평가되는 타그리소(오시머티닙, 아스트라제네카)와 효과를 비교한 것이다.현재 글로벌 빅 파마 존슨앤드존슨(J&J)는 조병철 교수가 제1저자 및 교신저자로서 주도한 MARIPOSA 연구를 근거로 FDA에 렉라자+리브리반트 병용요법 허가를 신청한 상태다. 조병철 교수는 빠르게 발전하고 있는 '폐암' 분야에서 국산 신약을 활용한 임상연구가 전 세계 의사들이 질병 진단과 치료 기준으로 삼는 학술지인 NEJM에 게재된 것은 큰 '쾌거'이자 '영광'이라고 소감을 밝혔다.특히 '한국인'이 전임상부터 개발까지 주도해 개발한 신약이 인정받은 것이라는 대해 큰 의미가 있다고 평가했다. 조병철 교수는 "개인적인 것은 차치하고 국가적으로 렉라자라는 약이 세계적인 학술지를 통해 인정을 받았다는 점이 가장 큰 의미가 있다"며 "한국인이 개발한 최초의 토종 항암제를 활용한 임상연구가 NEJM에 실린 것이다. 이제 남은 것은 토종 항암제가 최초로 FDA 허가를 받는 것"이라고 설명했다.이어 조병철 교수는 "이번 NEJM 게재가 우리나라가 바이오 강국으로 갈 수 있는 주춧돌이 될 수 있는 획기적인 일이라고 평가하고 싶다"며 "한국인의 힘으로 전 임상부터 글로벌 3상까지 전 과정을 책임져 개발까지 끝까지 이뤄낸 본토박이 신약으로 인정받은 것"이라고 말했다.지난 26일 NEJM에 조병철 교수가 제1저자와 교신저자(corresponding author)로 이름을 올린 'MARIPOSA' 연구가 게재됐다. 세계적 임상시험 책임자 반열 그렇다면 조병철 교수 개인적으로 이번 NEJM에 MARIPOSA 연구가 게재된 것은 어떤 의미일까.조병철 교수는 렉라자와 리브리반트 각각의 임상과 두 치료제의 병용요법까지 모두 임상을 주도해 성과를 이뤄냈다는 점을 꼽았다. 이번 NEJM 게재로 그는 세계적 임상시험의 총괄책임자(PI, Principal Investigator) 반열로 올라섰다는 평가다. 동시에 종양학에서 우리나라 최초의 제1저자와 교신저자(corresponding author)로 이름 석자를 새기게 됐다.조병철 교수는 "렉라자를 전임상부터 진행해 최종 임상 3상까지 PI를 맡았다. 리브리반트의 경우도 전임상 연구서부터 진행, 전 세계 환자등록도 처음으로 했다"며 "최종적으로 두 약제를 병용해 MARIPOSA 연구를 통해 1차 치료에서 효과를 입증했다는 점은 흔치 않은 사례"라고 의미를 부여했다.그는 "한 사람이 두 약제 단독요법 임상을 처음부터 끝까지 주도한 뒤 효과를 입증 하고, 두 치료제를 다시 병용해 임상 3상을 진행한 것"이라며 "한 사람이 이 부분을 이뤄내기가 어렵다는 점에서 이를 이뤄낸 것 같아 개인적으로는 그 부분에 의미가 있다"고 전했다. 한편, 현재 FDA는 J&J가 신청한 허가를 신청한 렉라자+리브리반트 병용요법을 우선 심사(Priority Review) 대상으로 선정해 검토 중이다. 여기에 추가로 J&J는 EGFR 변이 비소세포폐암 환자를 대상으로 피하투여(SC) 제형의 리브리반트 생물학적 제제 허가 신청서 제출하면서 리브리반트+렉라자 병용요법 허가 초읽기 속 편의성까지 확보하기 위해 나선 상황이다.