 로그인을 하시면 메디칼타임즈의
로그인을 하시면 메디칼타임즈의다양한 연관서비스를 이용하실 수 있습니다. 가입 시 등록한 정보를 입력해주세요.
 개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.
개인정보 보호를 위한 비밀번호 변경안내
주기적인 비밀번호 변경으로 개인정보를 지켜주세요.안전한 개인정보 보호를 위해 3개월마다 비밀번호를 변경해주세요. ※ 비밀번호는 마이페이지에서도 변경 가능합니다.
- 제약·바이오
- 외자사
폐암에서 불붙은 ADC 시장…글로벌 기업들 각축전
-
가
-
아스트라제네카, Dato-DXd FDA 허가 신청 '주목'
경쟁 치료제 '트로델비' 폐암 입증 실패 맞물려 관심
폐암 분야에서 글로벌 시장을 선점하기 위한 항체약물접합체(Antibody Drug Conjugate, ADC) 경쟁이 가속화되고 있다.
일단 다이이찌산쿄와 손을 잡고 치료제 개발에 몰두한 아스트라제네카가 치료제 허가를 받으며 한발 먼저 시장을 선점하는 모습이다.

21일 제약업계에 따르면, 최근 아스트라제네카는 다이이찌산쿄와 공동 개발 중인 다토포타맙 데룩스테칸(Dato-DXd)을 FDA에 '전신 치료를 받은 적이 있는 국소 진행성 또는 전이성 비편평 비소세포폐암(NSCLC) 치료제'로 바이오의약품 품목허가신청(Biologics License Application, BLA) 했다고 밝혔다.
Dato-DXd는 '엔허투(트라스투주맙 데룩스테칸)'에 이어 아스트라제네카와 다이이찌산쿄가 공동 개발 중인 ADC 신약 후보다. 테트라펩타이드 기반 링커를 통해 항-TROP2 인간화 IgG1 단일클론항체와 토포아이소머라제 I 억제제 페이로드(엑사테칸 유도체, DXd)를 연결했다.
만약 이대로 FDA가 승인한다면 폐암에서 첫 Trop2 ADC로 글로벌 시장에서 활용되게 되는 셈이다.
이 같은 Dato-DXd의 허가신청은 지난해 유럽임상종양학회 연례학술회의(ESMO Congress 2023)에서 공개한 TROPION-LUNG01 임상 3상 연구가 기반이 됐다.
연구는 이전에 치료받은 진행성/전이성 비소세포폐암 환자를 대상으로 Dato-DXd와 도세탁셀을 1:1 비교했다. 그 결과, Dato-DXd의 mPFS은 4.4개월, 도세탁셀군은 3.7개월로 나타났다. 확정 ORR은 다토포타맙군이 26.4%로 도세탁셀군이 기록한 12.8% 대비 차이를 보였다.
사실상 마지막 치료로 여겨지는 도세탁셀과 비교해서 효과를 입증했다는 점에서 허가 된다면 기존 치료에 실패한 환자들에게 Dato-DXd가 마지막 옵션으로 활용될 수 있을 전망이다.
아스트라제네카 항암제사업부 연구개발 수석 부사장수잔 갈브레이스(Susan Galbraith)는 "Dato-DXd은 이전 치료 경험이 있는 진행성 비편평 비소세포폐암 환자에게 기존 화학요법보다 효과적이고 내약성이 있는 대안을 제공할 수 있는 잠재력을 가지고 있다"며 "전 세계적으로 해당 약물의 허가 관련 논의 진행되고 있으며, 미국에서도 Dato-DXd의 유방암 적응증에 대한 허가 신청이 진행 중"이라고 말했다.
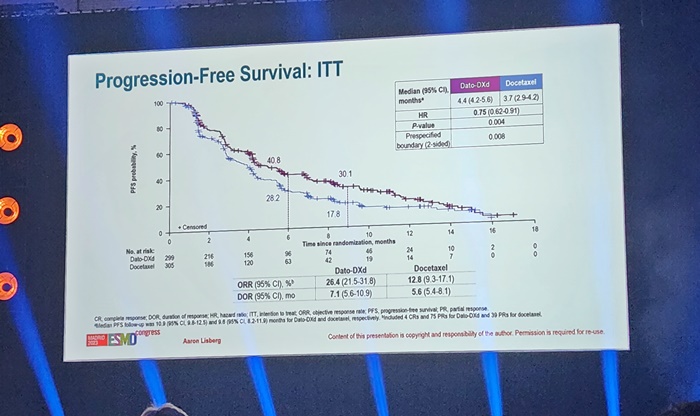
여기서 주목되는 점은 최근 경쟁 치료제의 상황이다.
길리어드 Trop2 표적 ADC인 트로델비(사시투주맙 고비테칸)가 최근 전이성 비소세포폐암 환자의 2차 치료제로서의 효과 입증에 실패했기 때문이다.
Dato-DXd와 마찬가지로 도세탁셀과 효과를 비교한 임상에서 트로델비는 전체생존기간(OS)에서 수치적으로 개선이 관찰됐지만, 1차 목표점을 충족하지는 못했다.
이 같은 트로델비의 상황과 Dato-DXd가 맞물리면서 국내 제약업계도 Trop2 표적 ADC의 폐암 시장 경쟁력을 주목하고 있다.
다만, 임상에서 드러난 효과 면에서는 활용도가 제한적일 수 있다는 의견이 적지 않다.
익명을 요구한 한 글로벌 제약사 임원은 "사실상 마지막 옵션으로 임상적 효과를 증명했다는 점에서 활용 가능성은 있다"며 "사실상 마지막 치료 옵션으로 임상현장에서 쓰일 수 있다"고 전망했다.
그는 "엔허투 후발주자로 Dato-DXd를 개발, 허가를 신청했지만 지난해 하반기를 기점으로 다이이찌산쿄가 아스트라네카가 아닌 MSD와 추가 ADC 후보물질 개발에 협력하기로 했다"며 "일단 아스트라제네카가 Dato-DXd를 어떻게 활용할지에 대해서는 더 지켜봐야 할 것 같다"고 평가했다.

관련기사
- 존재감 커진 ADC…글로벌 제약사 '협력' 경쟁 가열 2023-10-31 05:30:00
- 전 세계 항암전문가 유럽종양학회 집결 … 주요 임상 발표 초읽기 2023-10-21 00:04:29
- 코앞으로 다가온 ESMO 2023 '빅샷' 주인공 누가될까 2023-10-17 05:34:00
- 요동치는 글로벌 제약 시장…올해를 장식할 블록버스터는? 2023-01-09 05:30:00
제약·바이오 기사
- 심부전 치료제 시장 급속 확대…글로벌 기업 격전지 부상 2024-02-20 11:56:20
- 관심 높아진 '연속제조공정' 예시 모델 개발에 50억 투입 2024-02-20 11:07:48
- 통풍 치료제 진심인 JW중외제약…추가 임상도 돌입 2024-02-20 05:30:00
- 타그리소+화학요법 1차 치료 FDA 승인…국내 도입 가능할까 2024-02-20 05:30:00
- 식약처, 마약 안전망 구축…필수약 빠른 제품화 지원 2024-02-19 16:42:23
제약·바이오 기사
많이 읽은 뉴스
그 밖의 기술적 방법을 이용하여 무단으로 수집되는 것을 거부하며,
이를 위반할 시에는 정보통신망법에 의해 형사 처벌될 수 있습니다.




















- 최신순
- 추천순
댓글운영규칙ex) medi****** 아이디 앞 네자리 표기 이외 * 처리
댓글 삭제기준 다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입이 제한될 수 있습니다.
1. 저작권・인격권 등 타인의 권리를 침해하는 경우
2. 상용프로그램의 등록과 게재, 배포를 안내하는 게시물
3. 타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
4. 욕설 및 비방, 음란성 댓글